Schistosomiasis
| Klassifikation nach ICD-10 | |
|---|---|
| B65 | Schistosomiasis (Bilharziose) |
| ICD-10 online (WHO-Version 2019) | |
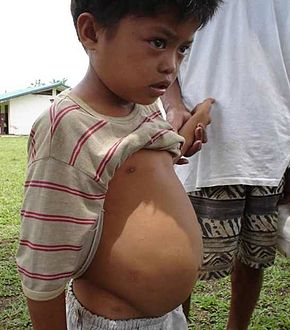
Schistosomiasis, auch Bilharziose (lateinisch Bilharziosis), ist eine durch die Larven von Saugwürmern der Gattung Pärchenegel (Schistosoma) verursachte Wurmerkrankung. Sie wird in warmen Binnengewässern durch Schnecken als Zwischenwirte verbreitet.
Erreger Bearbeiten
Krankheitserreger sind 1–2 cm lange Saugwürmer der Gattung Pärchenegel. Wimpernlarven der Saugwürmer befallen in warmen, ruhigen Süßwasser-Gewässern lebende Wasserschnecken. In ihnen entwickeln sich die Wimpernlarven zu Sporozysten. Diese vermehren sich ungeschlechtlich und entwickeln sich zu Zerkarien. Diese werden dann von den Wasserschnecken ausgeschieden und schwimmen frei im Wasser. Wenn die Zerkarien auf im Wasser schwimmende oder im Flachwasser watende Menschen treffen, bohren sie sich durch deren Haut. Danach gelangen sie als Metazerkarien über Lymph- und Blutgefäße in die Venen in der Darmwand und vor der Leber (Stromgebiet der Vena porta), wo sie zu erwachsenen Pärchenegeln reifen. Die Pärchenegel setzen sich in der Wand der Harnblase, dem Dickdarm oder dem Dünndarm fest. Dort erfolgt die geschlechtliche Fortpflanzung, so dass der Mensch der Hauptwirt der Pärchenegel ist. Von dort entlassen sie befruchtete Eier in die Blase oder in den Darm. Über Urin und Faeces werden die Eier ausgeschieden und können dann in Oberflächengewässer gelangen. Dort schlüpfen die Wimpernlarven, die dann wiederum in Süßwasserschnecken eindringen, die damit die Zwischenwirte darstellen. Damit ist der Vermehrungskreislauf der Parasiten geschlossen. Eine direkte Übertragung von Mensch zu Mensch ist ausgeschlossen.
Man unterscheidet mehrere Bilharziose-Erreger: Schistosoma haematobium verursacht die Blasenbilharziose (urogenitale Schistosomiasis). Dabei werden vornehmlich die ableitenden Harnwege und die Harnblase befallen. Dagegen befallen Schistosoma mansoni, Schistosoma intercalatum, Schistosoma japonicum und Schistosoma mekongi den Darm und können eine Darmbilharziose (intestinale Schistosomiasis) verursachen. Charakteristisch für alle Pärchenegel ist, dass das adulte Weibchen ein Leben lang in einer kanalartigen Vertiefung im Körper des adulten Männchen lebt.
Eine äußerst lästige, aber sonst meist harmlose Infektion mit unterschiedlichen Trichobilharzia-Arten (parasitiert Wasservögel) ist als Cerkarien- oder Zerkariendermatitis (siehe dort für Details) bekannt, wobei für Trichobilharzia regenti eine Schädigung der Neuronen und des Zentralnervensystems auch für Menschen nicht ausgeschlossen wird.[1][2]
Historisches Bearbeiten
Die Blasenbilharziose bzw. parasitäre Hämaturie taucht möglicherweise bereits im altägyptischen Papyrus Ebers als aaa-Krankheit auf.[3] Der Name der Bilharziose geht auf den deutschen Tropenarzt Theodor Bilharz zurück, der den Erreger (Distomum haematobium) bei Obduktionen in einer Kairoer Klinik 1851 entdeckte[4] und als Ursache der Bilharziosis nachwies.[5] Zunächst wurde der Parasit nach seinem Entdecker Bilharzia genannt.
Epidemiologie Bearbeiten
Der Arzt, Bakteriologe und Begründer der Paläopathologie Marc Armand Ruffer konnte Anfang des 20. Jahrhunderts bei seinen systematischen Untersuchungen von Tausenden Mumien, Mumienresten und Skeletten nachweisen, dass die Bilharziose schon im alten Ägypten in der 20. Dynastie verbreitet war.[6] Möglicherweise war sie mit der Aaa-Krankheit identisch.
Die Krankheit ist vor allem in Japan, der Volksrepublik China, den Philippinen, Afrika, der arabischen Halbinsel, Südamerika, der Karibik und dem Nahen Osten verbreitet. Es wird geschätzt, dass etwa 250 bis 300 Millionen Menschen von dem Parasiten befallen und 600 Millionen gefährdet sind. Durch Staudammbauten wie beispielsweise der Assuan-Staudamm in Ägypten und Bewässerungsprojekte nimmt das Erkrankungsrisiko zu.
Seit 2011 gibt es gesicherte Infektionen auch auf Korsika.[7] Betroffen sind Einheimische und Touristen, die Kontakt mit dem Wasser des Flüsschens Cavu/Cavo nahe dem Ort Sainte-Lucie-de-Porto-Vecchio (nördlich von Porto-Vecchio) im Südosten der Insel hatten. Es wurden Fälle bei Touristen aus Frankreich, Deutschland und Österreich diagnostiziert.[8][9]
Die für Menschen infektiöse Art Schistosoma haematobium auf Korsika enthält zu einem Viertel Erbgut vom Pärchenegel des Rinds, Schistosoma bovis. Die hybride Population befällt südeuropäische Schnecken wie die Ausweich-Art Bulinus truncatus im Fluss Cavu und verwandte Schnecken. Solche Hybriden waren bereits seit 2008 aus dem Senegal bekannt;[10] sie bewirken einen schweren Krankheitsverlauf.
Krankheitsverlauf und -anzeichen Bearbeiten
Erste Symptome sind Juckreiz an der Eintrittsstelle der Larven und die Bildung eines Hautausschlags, die Zerkariendermatitis. Die Zerkarien können auch unbemerkt durch gesunde Haut eindringen.
Schistosoma haematobium wandert dann durch das Gewebe und nach ca. 3–4 Wochen in die Lunge, was zu allergischen Reaktionen mit Ödembildung, Quaddelbildung, Husten und Fieber führen kann, dem Katayama-Fieber. Zerkarien von Schistosoma haematobium nisten sich dann in der Blasenwand ein und geben Eier in das Gewebe ab. Die Eier können Gewebe in Richtung Blasen-Lumen durchdringen und werden mit dem Urin ausgeschieden. Beim Gewebedurchtritt bewirken die Eier eine zelluläre entzündliche Reaktion in der Blasenwand, und es entstehen sogenannte Eigranulome. Da Schistosomen bis zu 20 Jahre im in der Nähe der Blasenwand befindlichen (perivesikulärem) Gewebe überleben können und ständig Eier ablegen, führt die chronische Entzündung zu Beschwerden beim Wasserlassen, Blut im Urin, Narbenbildung, und die Elastizität der Blasenwand schwindet langsam. In seltenen Fällen kann durch die chronische Infektion ein Plattenepithel-Karzinom (Blasenkrebs) entstehen, wodurch die Infektion dann eine Präkanzerose darstellt. (Dieser von Schistosoma haematobium (bilharzii) verursachte „Berufskrebs“ der im Nilschlamm arbeitenden Fellachen wurde 1888 als „Bilharziacarcinom“ erkannt[11]).
Die Zerkarien von Schistosoma mansoni wandern in die Darmwand und führen dort zu ähnlichen Reaktionen. Die Eier verursachen auch hier Eigranulome in der Darmwand, eine chronische Entzündung und Polyposis. Leber und Milz betreffende (hepatolienale) Schistosomenarten führen zu einer periportalen (zwischen den Leberläppchen liegende Strukturen des Lebergewebes) Fibrose der Leber mit portaler Hypertension (Erhöhung des Blutdruckes in der Pfortader von normal 3–6 mmHg auf über 12 mmHg)[12] und Milzvergrößerung. Selten kann sich auch eine cerebrale Schistosomiasis bilden,[13] oder die Parasiten wandern in das Rückenmark und legen dort Eier ab, die dann schwere Entzündungen und Lähmungen verursachen (Neuroschistosomiasis).[14] Ein lebensbedrohlicher Krankheitsverlauf kann in allen Stadien der Erkrankung auftreten.
-
Cercariendermatitis mit deutlich sichtbaren Eintrittsstellen der Larven durch die Haut
-
Histologische Untersuchung der Blase mit Schistosoma haematobium-Eiern
-
Eier von Schistosoma japonicum im Portalfeld der Leber
Diagnose Bearbeiten
Als diagnostische Tests[15] werden in der Regel der direkte Ei-Nachweis im Stuhl für S. mansoni (Kato-Katz-Test) oder immunologische Schnelltests (z. B. der CCA[16](Circulating Cathodic Antigen) point-of-care Test) angewandt, obwohl deren Testempfindlichkeit limitiert ist. Ein hoch sensitiver Nachweis ist mit neueren, molekularen Testmethoden im Prinzip möglich, diese sind für die breite Anwendung bei sogenannten Armutserkrankungen aber noch zu teuer.[17] Um die Kontrolle und womöglich die Ausrottung dieser Krankheit gemäß den globalen Entwicklungszielen der UNO[18] zu erreichen, besteht deshalb ein Bedarf nach neuen, sensitiven, spezifischen, günstigen Tests, welche den ASSURED Kriterien[19] der Weltgesundheitsorganisation (WHO) entsprechen.
Behandlung Bearbeiten
Die Schistosomiasis wird bei Infektionen mit adulten Schistosomen mit Praziquantel behandelt (bei Therapieversagen kommt – gegen Schistosoma mansoni – auch Oxamniquin in Betracht). Die Behandlung des Katayama-Syndroms erfolgt, da eine antiparasitäte Therapie nicht oder nur teilweise wirksam ist, symptomatisch mit Flüssigkeitsgabe, Antihistaminika und eventuell mit Kortikosteroiden.[20] Seit dem Jahr 2007 arbeitet die Merck KGaA mit der WHO daran, die Schistosomiasis auszurotten.[21][22] Merck stellt für die WHO für zehn Jahre jährlich über 25 Millionen Praziquantel-Tabletten kostenlos her. Damit können 27 Millionen Kinder behandelt werden.[23][24] 2012 gab Merck bekannt, die Anzahl der jährlich gespendeten Tabletten auf 250 Millionen zu verzehnfachen.[25][26] Laut WHO konnten 2014 weltweit rund 62 Millionen Menschen wegen Bilharziose behandelt werden, wogegen 150 Millionen Infizierte nicht mit Gegenmitteln versorgt werden konnten.[27] Die WHO führt die Krankheit in der Liste der vernachlässigten Krankheiten, also als eine Krankheit, die insbesondere für von Armut betroffene Menschen und Länder schwere Folgen hat, trotzdem aber weltweit wenig in der Forschung und Behandlung beachtet wird.[28]
Forschung Bearbeiten
1989 erhielten Aklilu Lemma (1935–1997) und Legesse Wolde-Yohannes den Right Livelihood Award zugesprochen; sie hatten herausgefunden, dass die sogenannte Endod-Pflanze Phytolacca dodecandra (eine Art aus der Gattung der Kermesbeeren) als preiswertes Mittel zur Vorbeugung gegen Bilharziose genutzt werden kann.[29] 2008 wurde die Wirksamkeit von Oxadiazol-Derivaten gegen den Pärchenegel entdeckt, zudem wird an der Entwicklung von Schistosomiasisimpfstoffen geforscht.
Literatur Bearbeiten
- 005 – S1-Leitlinie: Diagnostik und Therapie der Schistosomiasis (Bilharziose) Stand: 07/2013. (PDF) Deutsche Gesellschaft für Tropenmedizin und Internationale Gesundheit (DTG)/ AWMF online; abgerufen am 18. Juli 2014.
- K. H. Bichler et al.: EAU guidelines for the management of urogenital schistosomiasis. In: European Urology. Band 49, Nr. 1, 2006, S. 998–1003, doi:10.1016/j.eururo.2006.02.022, PMID 16519990.
- Richard Lucius, Brigitte Loos-Frank: Biologie von Parasiten (= Springer-Lehrbuch.). 2. Auflage, Springer, Berlin / Heidelberg 2008, ISBN 978-3-540-37707-8.
- Werner Köhler: Schistosomiasis (früher Bilharziose). In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1296 f.
Weblinks Bearbeiten
- Herwig Kollaritsch: Schistosomiasis. Patienteninfo vom Juni 2004, netdoktor.at; abgerufen am 18. Juli 2014.
- Bilharziose. fit-for-travel.de; abgerufen am 18. Juli 2014.
- Kurt F. de Swaaf: Tropischer Parasit – Würmer im Blut als Reisesouvenir. Spiegel Online, 21. Januar 2007; abgerufen am 18. Juli 2014.
- Schistosomiasis (Bilharziose): Merkblatt des Auswärtigen Amtes zur Bilharziose vom 1. Juni 2012; Volltext (PDF; 58 kB).
- Seite zu Schistosomiasis. UNHCO (englisch)
Einzelnachweise Bearbeiten
- ↑ L. Kolářová et al.: Histopathology of CNS and nasal infections caused by Trichobilharzia regenti in vertebrates. In: Parasitology Research. August 2001, Band 87, Nr. 8, S. 644–50, doi:10.1007/s004360100431.
- ↑ L. Lichtenbergová et al.: Trichobilharzia regenti: Host immune response in the pathogenesis of neuroinfection in mice. In: Experimental Parasitology. August 2011, Band 128, Nr. 4, S. 328–335, doi:10.1016/j.exppara.2011.04.006.
- ↑ Herbert Hof, Rüdiger Dörries: Medizinische Mikrobiologie: nach neuer AO - mit den Fächern: Immunologie, Virologie, Bakteriologie, Mykologie, Parasitologie, klinische Infektiologie, Hygiene (= Duale Reihe.). 3., komplett überarbeitete und erweiterte Auflage, Thieme, Stuttgart 2005, ISBN 3-13-125313-4, S. 562.
- ↑ Stefano Di Bella, Niccolò Riccardi, Daniele Roberto Giacobbe, Roberto Luzzati: History of schistosomiasis (bilharziasis) in humans: from Egyptian medical papyri to molecular biology on mummies. In: Pathogens and Global Health. Band 112, Nr. 5, 4. Juli 2018, ISSN 2047-7724, S. 268–273, doi:10.1080/20477724.2018.1495357, PMID 30016215, PMC 6225400 (freier Volltext) – (tandfonline.com [abgerufen am 29. August 2022]).
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 37.
- ↑ Marc Armand Ruffer: Note on the presence of „Bilharzia haematobia“ in egyptian mummies of the twentieth dynasty [1250-1000 B.C.]. In: British Medical Journal. Januar 1910, Band 1, Nr. 2557, S. 16, doi:10.1136/bmj.1.2557.16-a.
- ↑ RKI: Bilharziose: Häufung von Erkrankungsfällen bei Südkorsika-Reisenden. In: Epidemiologisches Bulletin. Nr. 20, 2014. Kurzmeldung des RKI zum Vorkommen von Schistosomen in Südkorsika vom 19. Mai 2014; abgerufen am 17. Juni 2014.
- ↑ Marton Szell: Schistosomiasis (Bilharziose) auf Korsika. (Memento vom 14. Juli 2014 im Internet Archive) dietropenordination.at, 11. Juli 2014; abgerufen am 17. Juli 2014.
- ↑ Lauriane Ramalli et al.: Persistence of schistosomal transmission linked to the Cavu river in southern Corsica since 2013 separator. In: Euro Surveillance. Band 23, Nr. 4, 2018, doi:10.2807/1560-7917.ES.2018.23.4.18-00017.
- ↑ A tropical parasitic disease has invaded Europe, thanks to a hybrid of two infectious worms. Auf: sciencemag.org vom 28. August 2018.
- ↑ Paul Obrecht: Klinische Cancerologie. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. Auflage ebenda 1961, S. 352–375, hier: S. 358–361 (Einflüsse des Berufs).
- ↑ Beate Schlosser: Prävalenz und Morbidität intestinaler Helminthen und Protozoen, sowie Nebenwirkungen nach antihelminthischer Therapie in einem Fischerdorf in Nordostbrasilien. Dissertation, Medizinische Fakultät Charité – Universitätsmedizin Berlin, Berlin 2009, S. 17.
- ↑ Claas Scharmann: Immundiagnostik der Schistosomiasis mit der mikrosomalen Antigenfraktion der Adultwürmer von Schistosoma mansoni. Dissertation, Ludwig-Maximilians-Universität München – Medizinischen Fakultät, 2011, S. 20, Abschnitt 1.7.7 Schistosomiasis des zentralen Nervensystems. (Volltext als PDF (PDF; 0,6 MB) ) (PDF; 596 kB).
- ↑ Bilharziose: Infektion durch Zerkarien erkennen und behandeln. In: ndr.de. Norddeutscher Rundfunk, 22. Januar 2023, abgerufen am 24. Januar 2023.
- ↑ J. Utzinger, S. L. Becker, L. van Lieshout, G. J. van Dam, S. Knopp: New diagnostic tools in schistosomiasis. In: Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. Band 21, Nr. 6, Juni 2015, ISSN 1469-0691, S. 529–542, doi:10.1016/j.cmi.2015.03.014, PMID 25843503.
- ↑ G. J. van Dam, J. H. Wichers, T. M. F. Ferreira, D. Ghati, A. van Amerongen: Diagnosis of Schistosomiasis by Reagent Strip Test for Detection of Circulating Cathodic Antigen. In: Journal of Clinical Microbiology. Band 42, Nr. 12, 1. Dezember 2004, ISSN 0095-1137, S. 5458–5461, doi:10.1128/jcm.42.12.5458-5461.2004.
- ↑ Patrick Hunziker, Maurice Mutro Nigo, Georgette B. Salieb-Beugelaar, Peter Odermatt, Manuel Battegay: Schistosomiasis: from established diagnostic assays to emerging micro/nanotechnology-based rapid field testing for clinical management and epidemiology. In: Precision Nanomedicine. Band 3, Nr. 1, Januar 2020, S. 439–458, doi:10.33218/prnano3(1).191205.1.
- ↑ Working to overcome the global impact of neglected tropical diseases – Summary. In: Releve Epidemiologique Hebdomadaire. Band 86, Nr. 13, 25. März 2011, ISSN 0049-8114, S. 113–120, PMID 21438440.
- ↑ Low-cost tools for diagnosing and monitoring HIV infection in low-resource settings. Auf: who.int, abgerufen am 22. Dezember 2019.
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. 2., überarbeitete und erweiterte Auflage. Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 293.
- ↑ ava: Merck Serono will Bilharziose ausrotten. In: Ärzte Zeitung vom 30. Januar 2012
- ↑ eb: Merck KGaA unterstützt Kampf gegen Bilharziose. In: Ärzte Zeitung vom 15. Dezember 2011
- ↑ Bekämpfung der Tropenkrankheit Bilharziose. (Memento vom 22. Dezember 2009 im Internet Archive) merck.de; abgerufen am 29. Juni 2010.
- ↑ Merck und WHO beschließen Partnerschaft. In: Ärzte Zeitung vom 26. April 2007.
- ↑ Merck verzehnfacht Tablettenspende, um Bilharziose auszurotten. (Memento vom 18. Mai 2012 im Internet Archive) merckgroup.com; abgerufen am 12. Februar 2012.
- ↑ Zanzibar: gearing up to eliminate schistosomiasis. who.int, 7. März 2012.
- ↑ Wurmkrankheit Bilharziose: Ein kaum bekannter Massenmörder. (handelsblatt.com [abgerufen am 23. Oktober 2016]).
- ↑ Neglected tropical diseases. who.int; abgerufen am 2. September 2020.
- ↑ Aklilu Lemma und Legesse Wolde-Yohannes. rightlivelihoodaward.org, 2016.