Mianserin
Mianserin ist – wie das Analogon Mirtazapin – ein Arzneistoff aus der Gruppe der tetrazyklischen Antidepressiva.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
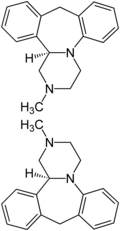
| ||||||||||||||||||||||
| 1:1-Gemisch aus (R)-Isomer (oben) und (S)-Isomer (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Mianserin | |||||||||||||||||||||
| Andere Namen |
(RS)-2-Methyl-1,2,3,4,10,14b-hexahydrodibenzo[c,f]pyrazino[1,2-a]azepin | |||||||||||||||||||||
| Summenformel | C18H20N2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 264,36 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte Bearbeiten
Während die älteren tetrazyklischen Substanzen – außer Mianserin selbst v. a. noch das Maprotilin – im Vergleich zu den Trizyklika keinen nennenswerten Fortschritt in Verträglichkeit und Effizienz darstellten, wurde die neuere Mianserin-Variante Mirtazapin als Vertreter eines eigenen Wirktyps (NaSSA) bezeichnet. Das sehr ähnlich wirkende Mianserin zählt inzwischen ebenfalls zu dieser Gruppe. Mianserin wurde 1967 von Organon patentiert[4] und wurde in Deutschland 1975 als Tolvin und in der Schweiz und Österreich als Tolvon zugelassen, es existieren zahlreiche Generika.
Wirkung Bearbeiten
Die Wirkung von Mianserin ist initial meist dämpfend. Die Indikationen entsprechen weitgehend denen der trizyklischen Antidepressiva vom Imipramin-Typ. Die mittlere Tagesdosis liegt bei 30–90 mg. Wegen der möglichen Schadeffekte sollte während der Einnahme regelmäßig das Blutbild untersucht werden. Die Halbwertszeit von Mianserin beträgt 17 Stunden.[5] Bei grippeähnlichen Symptomen (vgl. Agranulozytose) ist das Medikament sofort abzusetzen.
Bei einem Versuch, bei dem eine Vielzahl von Substanzen auf lebensverlängernde Wirkung bei Fadenwürmern getestet wurde, fiel Mianserin auf.[6]
Gegenanzeigen und Warnhinweise Bearbeiten
Im Gegensatz zu anderen Antidepressiva eignet sich Mianserin nicht zur Behandlung des neuropathischen Schmerzes. Die vegetativen Nebenwirkungen sind etwas geringer ausgeprägt als bei den meisten Trizyklika, allerdings hat Mianserin ein Risiko lebensbedrohlicher Störwirkungen (Blutbildungsstörungen, darunter Agranulozytose; weitere Knochenmarkschäden), wodurch es in der Regel nicht zu den Erstwahlmitteln bei Depression zählt.
Chemie Bearbeiten
Stereoisomerie Bearbeiten
Mianserin wird als Racemat [1:1-Gemisch der (S)-Form und der (R)-Form] eingesetzt, obwohl die (S)-Form die pharmakologisch aktivere ist.[7] Eine Racematspaltung mittels (+)- oder (–)-p-Ditoluoylweinsäure[8] wird beschrieben.[9]
Synthese Bearbeiten
Einen Überblick der Synthese von Mianserin ist in einem Nachschlagewerk beschrieben.[10] Auch bei der Erstanmeldung durch die Firma Organon[4] wurden mehrere Synthesemöglichkeiten vorgeschlagen. Zwei Strategien zum Aufbau des tricyclischen Dibenzoazepins haben sich durchgesetzt und werden angewendet:
Aufbau des 7-Ringes aus 2-Benzylanilin Bearbeiten
Der Weg über 2-Benzylanilin (1)[11] wurde vom Erfinder[4] verfolgt und wird auch in der älteren Literatur zitiert.[12] Das Dibenzoazepin wird über ein Imidchlorid (4) aus dem entsprechenden Chloracetanilid (3) mit Phosphoroxychlorid aufgebaut. Der Piperazinring des tetracyclischen Ringsystems von Mianserin wird aus dem durch Umsetzung mit Methylamin entstandenem 1,2-Diamin (5) mittels Oxalsäurediethylester (6) und anschließender Reduktion der Piperazindion-Zwischenstufe (7) mit Diboran zum Zielmolekül (8) geschlossen. Diese aufwendige aber selektive Piperazinsynthese wird weiterhin angewandt.[13]
Alternativ kann der Piperazinring mittels hochcanerogenem 1,2-Dibromethan aufgebaut werden.[14] 2-Benzylanilin stellt auch das Ausgangsmaterial für die chirale Synthese von Mianserin dar, die 2015 veröffentlicht wurde.[15] Anstelle von Methylamin wird Phthalimid eingesetzt und das erhaltene Dibenzazepin chiral hydriert.
Aufbau des 7-Ringes durch Einführung der Methylengruppe Bearbeiten
Diese Möglichkeit zum Aufbau des 7-Ringes mittels 2-Aminobenzylalkohol[16] wird in der neueren Patentliteratur beschrieben. Bereits 1975 wurde von Akzo, bis 2007 das Mutterunternehmen von Organon, ein Verfahren[17] angemeldet, bei dem der 7-Ring mittels 2-Aminobenzylalkohol (5) aufgebaut wurde. In nur vier Stufen wird Mianserin durch Umsetzung von Styroloxid (1) mit N-Methylaminoethanol (2), nach anschließender Chlorierung zur Zwischenstufe (4), Umsetzung mit 2-Aminobenzylalkohol (5) zur Diphenylpiperazin-Zwischenstufe (6) und Ringschluss mit Polyphosphorsäure zum Mianserin (7) synthetisiert.
1994 wird mit kleinen Änderungen dieser Weg nochmals beansprucht,[18] wobei das komplexe Reaktionsgemisch eine chromatografische Aufarbeitung der Endstufe erforderlich macht. Wegen dieses Umstandes wurde 1993 ein Verfahren mit Schutzgruppentechnik angemeldet,[19] das analog dem bisherigen Weg, aber mit Benzylaminoethanol (2) startet und das Reinigungen der Zwischenstufen über Salzbildungen vorsieht. Die Debenzylierung des Zwischenprodukts der Formel (7) gelingt mit Chlorameisensäure-n-butylester (8) zum Carbamat der Formel (9), das zum Nor-Mianserin (10) verseift wird. Im letzten Schritt erfolgt eine reduktive Methylierung, wodurch ein reineres Produkt (11) als bei dem direkte Weg erhalten wird. Trotz der größeren Zahl der Zwischenstufen wird dieser Weg mit einer Leuckart-Wallach-Reaktion zur Endstufe Mianserin offenbar immer noch in Fernost gewählt.[20]
1990 wurde noch ein weiteres Verfahren angemeldet,[21] bei dem das cancerogenverdächtige Edukt Styroloxid durch 2-Chlor-2-phenylacetylchlorid ersetzt wird, das nach analoger Umsetzung mit einem N-Methylamin das entsprechende Amid liefert, das dann aber erst nach anschließender Reduktion den äquivalenten Baustein des Phenylaminoethanols ergibt.
Einzelnachweise Bearbeiten
- ↑ The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 978-0-911910-00-1, S. 1064.
- ↑ a b Datenblatt Mianserin hydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- ↑ a b Eintrag zu Mianserin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ a b c Patent DE 1 695 556 (1967); Willem Jacob van der Burg;Jaques Delobelle (ORGANON); Verfahren zur Herstellung von Piperazinderivaten.
- ↑ Volkhard Kurowski: Intoxikationen. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 673–706, hier: S. 684 (Tetrazyklische Antidepressiva).
- ↑ M. Petrascheck et al.: An antidepressant that extends lifespan in adult Caenorhabditis elegans. In: Nature, Band 450, 2007, S. 553–556, PMID 18033297, doi:10.1038/nature05991.
- ↑ R.M.Pinder, A.M.L.Van Delft: The Potential Therapeutic Role of the Enantiomers And Metabolites Of Mianserin. In: Br.J.clin.Pharmac., 15, 269S(1983), PMC 1427891 (freier Volltext)
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu p-Ditoluoylweinsäure: CAS-Nummer: 32634-66-5, EG-Nummer: 251-131-7, ECHA-InfoCard: 100.046.468, PubChem: 3037000, ChemSpider: 87601, Wikidata: Q72469493.
- ↑ Patent WO 99 16 769; Jackson Roy William, Subasinghe Kamani Rupika (Monash University, Australia; Polychip Pharmaceuticals Pty. Ltd.); Resolution of optically-active compounds.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände. Thieme-Verlag, Stuttgart 2000, ISBN 978-1-58890-031-9.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Benzylanilin: CAS-Nummer: 28059-64-5, EG-Nummer: 248-806-3, ECHA-InfoCard: 100.044.355, PubChem: 119805, ChemSpider: 106974, Wikidata: Q72440687.
- ↑ W J Van der Burg, I L Bonta, J Delobelle, C Ramon, B Vargaftig: Novel type of substituted piperazine with high antiserotonin potency. In: J.Med.Chem., 13, 1970, 35, doi:10.1021/jm00295a010
- ↑ Hulinska Hana, Polivka Zdenek, Jilek Jiri et al.: Experimental antiulcer agents: N-substituted 2-(4-methyl-1-piperazinyl)acetamides as pirenzepine models and some related compounds. In: Collect.Czech.Chem.Commun., 53, 1988, 1820. cccc.uochb.cas.cz Chem.Abstr.1989: 439 321
- ↑ Patent US 4 217 452 (1980); Olivie Jacques (Akzono); Synthesis for the preparation of tetracyclic compounds.
- ↑ Piotr Roszkowski, Jan. K. Maurin, Zbigniew Czarnocki: The enantioselective synthesis of (S)-(+)-mianserin and (S)-(+)-epinastine. In: Beilstein Journal of Organic Chemistry, 11, 2015, 1509, beilstein-journals.org
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Aminobenzylalkohol: CAS-Nummer: 5344-90-1, EG-Nummer: 226-293-7, ECHA-InfoCard: 100.023.903, PubChem: 21439, ChemSpider: 20149, DrugBank: DB03058, Wikidata: Q27094019.
- ↑ Patent DE 2 505 239 (1975); Olivie Jaques (AKZO N V Neth); Verfahren zur Herstellung tetracyclischer Verbindungen.
- ↑ Patent PL 175 287 (1998); Lypacewicz Maria K, Poslinska-bucewka Halina, Smolinska Jadwiga et al. (Instytut Farmaceutyczny, Warszawa); Preparation of 1,2,3,4,10,14b-hexahydro-2-methyldibenzo[c,f]pyrazino[1,2-a]azepine.; Chem.Abstr. 130, 296 698 (1999).
- ↑ Patent DE 4 305 659 (1993); Kisielowski-Ruppert, Lothar; Mörsdorf, Johann Peter; Grafe, Ingomar; Ahrens, Kurt-Henning (HEUMANN Pharma GmbH & Co); Verfahren zur Herstellung von 1,2,3,4,10,14b-Hexahydro-2-methyl-dibenzo[c,f]- pyrazino[1,2-a]azepin und seiner Salze.
- ↑ Patent CN 101 544 644 (2009); Zhao, Zhenqiao. (Shandong Renhetang Pharmaceutical Co., Ltd., Peop. Rep. China); Process for preparation of mianserin hydrochloride.; Chem.Abstr. 2009: 1 216 535.
- ↑ Patent CH 678 623 (1990); Haider Akhtar, Bollinger Heinrich, Fischer Alan (S. A. SOCHINAZ, Switz.); Procédé de Preparation d’un composé tetracyclique.