Piperazin
Das Piperazin ist eine organische, heterocyclische Verbindung. Reines Piperazin ist ein weißes, stark hygroskopisches Pulver, dessen Geschmack als salzig und bitter beschrieben ist.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
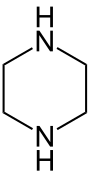
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Piperazin (bevorzugter IUPAC Name) | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H10N2 | ||||||||||||
| Kurzbeschreibung |
blättchenartige, farblose, hygroskopische Kristalle, aminartiger Geruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 86,14 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,1 g·cm−3 (20 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
146 °C[1] | ||||||||||||
| Löslichkeit | |||||||||||||
| Brechungsindex |
1,446 (113 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||
Geschichte
BearbeitenSeinen Namen erhielt Piperazin aufgrund der Ähnlichkeit mit Piperidin, einer Komponente des im Schwarzen Pfeffer vorkommenden Alkaloids Piperin.
Piperazin war 1890 das erste Medikament, das die Schering AG auf den Markt brachte. Ursprünglich als Verjüngungsmittel gedacht, wurde es später zuerst zur Behandlung der Gicht und dann als Anthelminthikum eingesetzt. Heute ist Piperazin ein Ausgangsstoff für die Synthese von Arzneistoffen.
Gewinnung und Darstellung
BearbeitenPiperazin kann durch Umsetzung von Ammoniak mit 1,2-Dichlorethan in Ethanol oder durch Reduktion von Pyrazin mit Natrium in Ethanol dargestellt werden. Es entsteht als Nebenprodukt bei der industriellen Herstellung von Ethylendiamin. Die dabei gebildeten Mengen sind so groß, dass eine gezielte Herstellung zur Abdeckung des kommerziellen Bedarfs nicht nötig ist.
Eigenschaften
BearbeitenPiperazin ist in Wasser gut, in Alkohol etwas weniger, in Ether nicht löslich. Es ist stark hygroskopisch und bildet bei Vorhandensein von Wasser weißliche Kristalle mit einem Gehalt von 44,34 % wasserfreiem Piperazin, das Piperazin-Hexahydrat (CAS-Nummer: 142-63-2). Das Hexahydrat ist, ebenso wie andere Salze (Adipat, Chlorid, Citrat) stabiler als wasserfreies Piperazin. Außerdem ist Piperazin eine starke Base mit einem pKB-Wert von 4,19. Eine 10%ige wässrige Lösung von Piperazin zeigt einen pH-Wert von 10,8–11,8.[5]
Verwendung
BearbeitenPiperazin und Derivate in der Medizin
BearbeitenPiperazin bei Gicht
BearbeitenDie historische Verwendung von Piperazin zur Behandlung der Gicht beruhte auf der Beobachtung, dass es in vitro die Harnsäure aufzulösen vermag. Wesentlich niedriger war jedoch die Wirksamkeit in vivo, also im menschlichen Körper. Piperazin wird zwar gut resorbiert, jedoch auch schnell wieder ausgeschieden. Die Ausscheidung erfolgt über den Urin.
Piperazin als Anthelminthikum
BearbeitenEtwas erfolgreicher war Piperazin als Anti-Wurmmittel. Es wurde sowohl in der Veterinärmedizin als auch in der Humanmedizin bei Wurmbefall zum Beispiel durch Spulwürmer und Oxyuren eingesetzt, ist heute aber durch verträglichere Anthelminthika, bzw. solche mit einem breiteren Wirkungsspektrum ersetzt worden. Aufgrund des salzig-bitteren Geschmacks und der chemischen Instabilität wurde kein reines Piperazin (Piperazinbase) verwendet, sondern eines der wesentlich stabileren Salze, meist Piperazin-citrat- oder -adipat. Seitdem man weiß, dass sich in dem sauren Milieu des Magens potentiell mutagene und karzinogene N-Nitrosopiperazine bilden können, sind Piperazinsalze heute vollständig durch andere Präparate ersetzt worden. Die Wirksamkeit des Piperazins gegen Würmer begründete man zuerst mit einer inhibierenden Wirkung des Acetylcholins. Die Blockade dieses Neurotransmitters würde zu einer Paralyse der Parasiten führen, damit die Erregungsübertragung zwischen Nerv und Muskel stören. Dieses deckte sich mit der Beobachtung, dass die Parasiten zwar gelähmt, aber noch lebend, im Kot ausgeschieden werden.[6][7][8][9]
Mittlerweile weiß man, dass Piperazin eine GABA-agonistische Wirkung hat. Dieser Neurotransmitter kommt bei Vertebraten nur im ZNS vor, außerdem unterscheidet sich der GABA-Rezeptor der Würmer (Helminthen) etwas von dem der Vertebraten, womit die selektive Wirkung des Piperazins erklärt werden kann.[10] Eine exakte Dosierung von Piperazin bzw. Piperazin-Salzen ist dennoch erforderlich, da es bei einer Überdosierung die Blut-Hirn-Schranke bei Säugern passiert.
Piperazinderivate als Arzneistoffe
BearbeitenIn einer Reihe von Arzneistoffen findet sich eine Piperazin-Teilstruktur:
|
|
|
Sonstige Verwendung
BearbeitenPiperazin wird u. a. als Ausgangsprodukt zur Herstellung von Kunststoffen verwendet. Durch Umsetzung von Ethylencarbonat mit Piperazin und anschließender Umsetzung mit Dicarbonsäuredichloriden werden Polyesterurethane erhalten.
Weiter werden etliche Piperazinderivate als psychoaktive Drogen konsumiert, z. B. Benzylpiperazin (BZP), Trifluormethylphenylpiperazin (TFMPP) oder meta-Chlorphenylpiperazin (mCPP).
Außerdem findet Piperazin Anwendung als Additiv in Alkali-Carbonat-basierten Sauergaswäscheverfahren, wie dem Benfield Prozess (Hot potassium carbonate process).[11]
Sicherheitshinweise
BearbeitenDie Symptome einer Überdosierung von Piperazin zeigen sich vor allem durch das Auftreten neurotoxischer Nebenwirkungen (Tremor, Ataxie, Konvulsionen, Paresen) sowie gastrointestinalen Beschwerden (Erbrechen, Diarrhoe). Typisch für eine Intoxikation durch Piperazin ist das verzögerte Auftreten der Beschwerden nach etwa 24 Stunden.[12][13]
Weblinks
Bearbeiten- Eintrag zu Piperazin bei Vetpharm, abgerufen am 5. August 2012.
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Eintrag zu Piperazin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-436.
- ↑ Eintrag zu Piperazine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. Cavier: Chemotherapy of intestinal nematodes. In: Chemotherapy of helminthiasis, Pergamon Press, Oxford (UK), 1, 1973, S. 215–436.
- ↑ a b C.H. Courtney et al.: Antinematodal Drugs. In: Veterinary Pharmacology and Therapeutics Iowa State University Press, Ames (USA), 1995, S. 885–932, ISBN 0-8138-1741-2.
- ↑ J. Del Castillo et al.: Inhibitory action of gamma-aminobutyric acid (GABA) of Ascaris muscle. In: Experientia 20, 1964, S. 141–143, PMID 5853680.
- ↑ J. Del Castillo et al.: Action of piperazine on the neuromuscular system of Ascaris lumbricoides., In: Nature, 200, 1963, S. 706–707, PMID 14109979.
- ↑ B. R. Manger: Anthelmintics. In: Veterinary Applied Pharmacology & Therapeutics, Baillière Tindall, London (UK) 1991, S. 513–548, ISBN 0-7020-1366-8.
- ↑ M. L. Aubry: Aspects of the pharmacology of a new anthelmintic: Pyrantel. In: Br J Pharmacol, 38, 1970, S. 332–344, PMID 5417856.
- ↑ R. J. Martin: Electrophysiological effects of piperazine and diethylcarbamazine on Ascaris suum somatic muscle. In: Br J Pharmacol, 77, 1982, S. 255–265, PMID 7139188.
- ↑ P. Behr, A. Maun, K. Deutgen, A. Tunnat, G. Oeljeklaus: Kinetic study on promoted potassium carbonate solutions for CO2 capture from flue gas. In: Energy Procedia. Band 4, 2011, S. 85–92, doi:10.1016/j.egypro.2011.01.027.
- ↑ D. Kömpf, B. Neundörfer: Neurotoxische Nebenwirkungen des Piperazins im Erwachsenenalter – Epileptischer Dämmerzustand mit Myoklonien. In: European Archives of Psychiatry and Clinical Neuroscience, 213 (3), 1974, S. 223–233, doi:10.1007/BF02401381.
- ↑ P. Schuch et al.: Nebenwirkungen bei Wurmkuren mit Piperazinpräparaten. In: European Journal of Pediatrics, 87 (6), 1963, S. 531–546, doi:10.1007/BF00447192.


