Isomannid
Isomannid ist ein aus zwei cis-ständigen Tetrahydrofuran-Ringen anellierter bicyclischer sauerstoffhaltiger Heterocyclus aus der Gruppe der Diole. Wie die stereoisomeren – auch als Isohexide bezeichneten – 1,4:3,6-Dianhydrohexitole Isosorbid (aus D-Sorbit) und Isoidid (aus L-Iditol) ist Isomannid aus dem Präkursor-Zuckeralkohol D-Mannit (D-Mannitol) durch zweifache Dehydratisierung zugänglich. Isomannid wird besonders als Diolkomponente aus nachwachsenden Rohstoffen für Polyester, Polycarbonate und Polyurethane diskutiert.[5]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
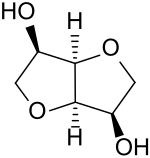
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Isomannid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H10O4 | |||||||||||||||
| Kurzbeschreibung |
weißes bis hellgelbes Kristallpulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,14 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen und Darstellung
BearbeitenDarstellung und Eigenschaften von Isomannid wurden erstmals 1884 beschrieben.[4] Beim Erhitzen von Mannit (aus D-Fructose durch katalytische Hydrierung) mit der 10-fachen Menge Salzsäure für 24h entsteht Isomannid, der zunächst als sirupöse Flüssigkeit anfällt, die zu einer kristallinen Masse erstarrt.
Die Isomannidausbeute bei der säurekatalysierten Dehydratisierung von Mannit lässt sich bei Verwendung von kristallinen sauren Zeolithen bis auf 63 % steigern.[6]
Die Dehydratisierung von Mannit verläuft auch ohne Säurezusatz bei hohen Temperaturen (573K) in flüssigem Wasser, wobei durch Abspaltung eines Wassermoleküls zunächst die Monoanhydrohexitole 1,4- und 2,5-Anhydromannit gebildet werden, die unter weiterer Wasserabspaltung in bescheidener Ausbeute (ca. 20 %) zu Isomannid reagieren.[7]
Statt des verhältnismäßig teuren Mannits kann auch das in industriellem Maßstab verfügbare Isosorbid als Rohstoff für Isomannid verwendet werden. Bei der katalytischen Isomerisierung von Isosorbid mit Wasserstoff (10,3 MPa) in Gegenwart eines Nickelkatalysators bei 200–230 °C bildet sich ein Gleichgewichtsgemisch der drei Dianhydrohexitole, in dem allerdings nur weniger als 10 % Isomannid vorliegt.[8]
Am effizientesten erscheint die Oxidation von Isosorbid mit Sauerstoff in Gegenwart eines Platin-Katalysators[9] oder mittels Nitraten und Nitriten, sowie dem Oxidationsmittel 4-Acetamido-TEMPO (AA-TEMPO) zum Diketon 2,6-Dioxabicyclo-(3.3.0)-octan-4,8-dion in hohen Ausbeuten von über 95 %.[10]
Das Diketon kann z. B. mit Natriumborhydrid NaBH4 in wässriger Lösung in 90%iger Ausbeute selektiv zum Diol Isomannid reduziert werden.[11]
Eigenschaften
BearbeitenIsomannid ist ein weißer bis hellgelber leicht hygroskopischer Feststoff, der sich sehr gut in Wasser löst. In wässriger Lösung zeigt die Substanz optische Aktivität und ist rechtsdrehend (αD = 91°, 6 % in H2O).[4] Auch in polaren Alkoholen, wie Methanol oder Ethanol ist Isomannid gut löslich. Sein Schmelzpunkt ist mit 86 °C deutlich höher als der anderen Isohexide Isoidid (64–65 °C) und Isosorbid (61–64 °C). Nach Arthur C. Cope liegen die beiden Hydroxygruppen in endo-Konfiguration vor und bilden intramolekulare Wasserstoffbrücken.[12]
Anwendungen
BearbeitenDie Mono- und Dinitrate von Isomannid wirken wesentlich weniger gefäßerweiternd als die entsprechenden Isosorbid-Nitrate ISMN (Isosorbidmononitrat) und ISDN (Isosorbiddinitrat)[13] und sind daher therapeutisch bedeutungslos.
Analog zu den Sorbitanfettsäureestern werden aus Isomannid durch Veresterung mit langkettigen Carbonsäuren nichtionische Tenside gebildet.[14]
Das chirale und starre „Zuckerdiol“ Isomannid ist interessant als Monomerbaustein für Polykondensate,[15] z. B. Polyester und für Polyadditionsprodukte, z. B. Polyurethane.[16] Allerdings zeigt das endo-endo-Diol Isomannid deutlich geringere Reaktivität in Polykondensationsreaktionen mit Dicarbonsäuren und niedrigere Molmassen der gebildeten Polyester[17] als die Isohexide Isosorbid und Isoidid.[5] Nachteilig sind auch die thermische Instabilität mit Verfärbung und die Verzweigung und Vernetzung durch partielle Spaltung eines Tetrahydrofuran-Rings aus dem bicyclischen Isomannidsystem.
Die schonende enzymatische Veresterung mittels Lipasen liefert Polyester mit unbefriedigend niedrigen Molmassen.[18]
Unlängst wurde die ringöffnende Polymerisation von cyclischen oligomeren Isomannid-2,5-furandicarbonsäure-estern mit cyclischen Oligo(butylen-2,5-furandicarboxylat) beschrieben, die unter Zinn(II)-2-ethylhexanoat-Katalyse zu vollständig biobasierten Copolyestern mit hohen Glasübergangstemperaturen Tg und guter Bioabbaubarkeit umgesetzt werden können.[19]
Diamine ausgehend von Isomannid sind als Molekülbausteine für Polyamide und Polyurethane von Interesse.[5][20] In einer Gabriel-Synthese kann das Ditosylat (2) des Isomannids (1) mit Phthalimidkalium unter Walden-Umkehr zum Diphthalimidoisoidid (3) umgesetzt werden, das säurekatalysiert zu einem Gemisch aus Monoaminoisoidid-hydrochlorid (4) und überwiegend Diaminoisoidid-dihydrochlorid (5) reagiert. Aus (5) lässt sich das 2,5-Diaminoisoidid (6) in einer Gesamtausbeute von ca. 50 % gewinnen.[21]
Für eine industrielle Herstellung des Diamins ist diese mehrstufige Synthese ungeeignet, ebenso wie die mögliche Alternativroute mit Natriumazid in ionischen Flüssigkeiten über das Diazid.[22]
Die aus den Arbeitskreisen von Matthias Beller[23] und Dieter Vogt[24] stammende direkte Aminierung der Dianhydrohexitole Isosorbid bzw. Isomannid mittels Ruthenium-Phosphinkomplex-Katalysatoren in homogener Phase liefert praktisch quantitative Ausbeuten an Isohexiddiamingemischen – im Falle des Isomannids als Ausgangsstoff in der Zusammensetzung 14,9 % Diaminoisomannid + 36,1 % Diaminoisoidid + 44,7 % Diaminoisosorbid. Die (aufwendige) Isolierung und Reinigung des prozentual am wenigsten gebildeten Zielprodukts 2,5-Diaminoisomannid ist jedoch nicht angegeben.
Am leistungsfähigsten zur Erzeugung des Diaminoisomannids erscheint die Synthese aus dem Diketon[9][10] über das Diimin und dessen Hydrierung an einem Nickel-Kontakt.[25]
Dabei fällt in 96%iger Ausbeute ein Gemisch aus deutlich höherem Diaminoisomannidanteil (60 %) neben Diaminoisosorbid (35 %) und Diaminoisoidid (5 %) an. Eine Auftrennung dieses Gemischs ist ebenfalls nicht beschrieben.
Zudem wurden mit Diaminoisomannid als Diaminkomponente Polyamide mit den niedrigsten Molmassen aller Diaminoisohexide erhalten,[26][5] die technisch uninteressant sind.
Die im Vergleich zu Isosorbid schlechtere Zugänglichkeit und der dadurch bedingte höhere Preis, besonders aber die deutlich geringere Reaktivität der beiden sekundären Hydroxygruppen machen Isomannid als Ausgangsstoff für weitere Synthesen weniger attraktiv.[8] Thermische Instabilität (Verfärbung) und Neigung zu Nebenreaktionen (Verzweigung und Vernetzung) unter Polykondensationsbedingungen schränken das Potential von Isomannid als Monomer weiter ein und wecken Zweifel an der Zukunft von Isomannid als relevantem Synthese- und Polymerbaustein aus nachwachsenden Rohstoffen.
Einzelnachweise
Bearbeiten- ↑ a b c d Eintrag zu Isomannide bei TCI Europe, abgerufen am 15. Januar 2019.
- ↑ a b c Datenblatt 1,4:3,6-Dianhydro-D-mannitol bei Sigma-Aldrich, abgerufen am 15. Januar 2019 (PDF).
- ↑ a b U. Koert: Isomannide and Isosorbide. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2012, doi:10.1002/047084289X.rn01380.
- ↑ a b c d e f g A. Fauconnier: Anhydride de la mannite. In: Bull. Soc. Chim. France. Band 2, Nr. 41, 1884, S. 119–125 (bnf.fr).
- ↑ a b c d F. Fenouillot, A. Rousseau, G. Colomines, R. Saint-Loup, J.-P. Pascault: Polymers from renewable 1,4:3,6-dianhydrohexitols (isosorbide, isomannide and isoidide): a review. In: Progress Polym. Sci. Band 35, Nr. 5, 2010, S. 578–622, doi:10.1016/progpolymsci.2009.10.001.
- ↑ H. Yokoyama, H. Kobayashi, J. Hasegawa, A. Fukuoka: Selective dehydration of mannitol to isomannide over Hβ zeolite. In: ACS Catal. Band 7, Nr. 7, 2017, S. 4828–4834, doi:10.1021/acscatal.7b01295.
- ↑ A. Yamaguchi, O. Sato, N. Mimura, M. Shirai: Intramolecular dehydration of mannitol in high-temperatur liquid water without acid catalysts. In: RSC Adv. Band 4, Nr. 85, 2014, S. 45575–45578, doi:10.1039/C4RA09198A.
- ↑ a b M. Rose, R. Palkovits: Isosorbide as a renewable platform chemical for versatile applications – quo vadis? In: ChemSusChem. Band 5, Nr. 1, 2012, S. 167–176, doi:10.1002/cssc.201100580.
- ↑ a b K. Heyns, W.-P. Trautwein, H. Paulsen: Über katalytische Oxidationen, XX. Selektive katalytische Oxidation von 1.4;3.6-Dianhydro-hexiten. In: Chem. Ber. Band 96, Nr. 12, 1963, S. 3195–3199, doi:10.1002/cber.19630961214.
- ↑ a b Patent EP2393817B1: Verfahren zur Herstellung von 2,6-Dioxabicyclo-(3.3.0)-octan-4,8-dion. Angemeldet am 26. Januar 2010, veröffentlicht am 27. März 2013, Anmelder: Evonik Degussa GmbH, Erfinder: U. Dingerdissen et al..
- ↑ Patent WO2018112774A1: Process for preparing isomannide, monoketones and mixtures thereof. Angemeldet am 21. Dezember 2016, veröffentlicht am 28. Juni 2018, Anmelder: Rhodia Operations, Erfinder: M. Corbet, J. Lai.
- ↑ A.C. Cope, T.Y. Shen: The stereochemistry of 1,4:3,6-dianhydrohexitol derivatives. In: J. Amer. Chem. Soc. Band 78, Nr. 13, 1956, S. 3177–3182, doi:10.1021/ja01594a055.
- ↑ M.G. Bogaert, M.T. Rosseel: Vascular effects of the dinitrate and mononitrate esters of isosorbide, isomannide and isoidide. In: Naunyn-Schmiedebergs Archiv. Band 275, Nr. 3, 1972, S. 339–342, doi:10.1007/BF00500061.
- ↑ T.V. K. Reddy, G.S. Ravi, R.B.N. Prasad, B.L.A.P. Devi: Green recyclable SO3H-carbon catalyst for the selective synthesis of isomannide-based fatty acid monoesters as non-ionic bio-surfactants. In: RSC Adv. Band 5, Nr. 51, 2015, S. 40997–41005, doi:10.1039/C5RA03605D.
- ↑ H.R. Kricheldorf: “Sugar Diols” as building blocks of polycondensates. In: J. Macromol. Sci., Part C. Band 37, Nr. 4, 1997, S. 599–631, doi:10.1080/15321799708009650.
- ↑ M.D. Zenner, Y. Xia, J.S. Chen, M.R. Zenner: Polyurethanes from isosorbide-based diisocyanates. In: ChemSusChem. Band 6, Nr. 7, 2013, S. 1182–1185, doi:10.1002/cssc.201300126.
- ↑ Bart A.J. Noordover: Biobased step-growth polymers: chemistry, functionality and applicability. Hrsg.: Technische Universität Eindhoven, Dissertation. Eindhoven 2008, doi:10.6100/IR631662.
- ↑ A.F. Naves, H.T.C. Fernandez, A.P.S. Immich, L.H. Catalani: Enzymatic syntheses of unsaturated polyesters based on isosorbide and isomannide. In: J. Polym. Sci. Band 51, Nr. 18, 2013, S. 3881–3891, doi:10.1002/pola.26789.
- ↑ J.C. Morales-Huerta, A. Martinez de Illarduya, S. León, S. Munoz-Guerra: Isomannide-containing poly(butylene-2,5-furandicarboxylate) copolyesters via ring-opening polymerization. In: Macromolecules. Band 51, Nr. 9, 2018, S. 3340–3350, doi:10.1021/acs.macromol.8b00487.
- ↑ M. Janvier, S. Moebs-Sanchez, F. Popowycz: Nitrogen-functionalized isohexides in asymmetric induction. In: Chimia. Band 70, Nr. 1/2, 2016, S. 77–83, doi:10.2533/chimia.2016.77.
- ↑ S. Thiyagarajan, L. Gootjes, W. Vogelzang, J. Wu, J. van Haveren, D.S. van Es: Chiral building blocks from biomass: 2,5-diamino-2,5-dideoxy-1,4-3,6-dianhydroiditol. In: Tetrahedron. Band 67, Nr. 2, 2011, S. 383–389, doi:10.1016/j.tet.2010.11.031.
- ↑ T.G. Barros et al.: Pseudo-peptides derived from isomannide: inhibitors of serine proteases. In: Amino Acids. Band 38, Nr. 3, 2010, S. 701–709, doi:10.1007/s00726-009-0273-4.
- ↑ S. Imm et al.: Improved ruthenium-catalyzed amination of alcohols with ammonia: Synthesis of diamines and amino esters. In: Angew. Chem. Int. Ed. Band 50, Nr. 33, 2011, S. 7599–7603, doi:10.1002/anie.201103199.
- ↑ D. Pingen, O. Diebolt, D. Vogt: Direct amination of bio-alcohols using ammonia. In: ChemCatChem. Band 5, Nr. 10, 2013, S. 2905–2912, doi:10.1002/cctc.201300407.
- ↑ Patent US9029412B2: Method for preparing diamino-dianhydro-dideoxyhexitols, particularly preferably 2,5-diamino-1,4:3,6-dianhydro-2,5-dideoxy-D-hexitol. Angemeldet am 28. Juni 2011, veröffentlicht am 12. Mai 2015, Anmelder: Evonik Degussa GmbH, Erfinder: G. Streukens, C. Lettmann, S. Schneider.
- ↑ J. Thiem, F. Bachmann: Synthesis and properties derived from anhydro- and dianhydroalditols. In: Macromol. Chem. Band 192, Nr. 9, 1991, S. 2163–2182, doi:10.1002/macp.1991.021920922.