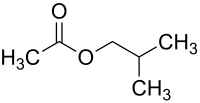
Essigsäureisobutylester, oft auch als Isobutylacetat bezeichnet, ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureester. Der Ester leitet sich von der Essigsäure und von Isobutanol ab. Isomere Verbindungen, die sich von anderen isomeren Butanolen ableiten, sind n-Butylacetat und sec-Butylacetat, sowie tert-Butylacetat.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Essigsäureisobutylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H12O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 116,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,87 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
118 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,3902 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
BearbeitenEssigsäureisobutylester ist ein Fruchtester, der in vielen Früchten enthalten ist. Eine wichtige Komponente ist er beispielsweise in Bananen[6][7] und Melonen.[8][9][10] Er kommt außerdem in Äpfeln,[11] Birnen,[12] Pflaumen,[13] Papaya,[14] Pfirsich[15] und Plattpfirsich,[16] Erdbeeren,[17] Blaubeeren,[18] Litschi,[19] Feigen,[20] Nektarinen,[15] sowie in Mangaba,[21] Curuba[22] und den Früchten von Strychnos cocculoides (Gattung Brechnüsse)[23] vor. Auch in alkoholischen Getränken wie Apfelwein[24] und Maulbeerwein[25] kommt die Verbindung vor.
Gewinnung und Darstellung
BearbeitenEssigsäureisobutylester wird großtechnisch durch säurekatalysierte Veresterung von Essigsäure mit Isobutanol bei Temperaturen von 110–120 °C in Reaktionskolonnen hergestellt.[26]
Als Katalysatoren eignen sich neben Mineralsäuren wie Schwefelsäure, auch saure Ionentauscherharze oder Zeolithe.[26] Im Labormaßstab wird als Katalysator meist p-Toluolsulfonsäure verwendet.[27]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenEssigsäureisobutylester hat eine relative Gasdichte von 4,01 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,06 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Außerdem weist Isobutylacetat einen Dampfdruck von 19,9 hPa bei 20 °C, 33,9 hPa bei 30 °C, 55,4 hPa bei 40 °C und 87,7 hPa bei 50 °C auf. Die Verdunstungszahl beträgt 7,2.[2] Mit Wasser bildet die Verbindung ein bei 87,4 °C azeotrop siedendes Gemisch.[28] Die Mischbarkeit mit Wasser ist nur gering. In Wasser lösen sich bei 20 °C nur 0,67 Ma% Ester bzw. im Ester lösen sich bei 20 °C nur 1,65 Ma% Wasser.[29]
Thermodynamische Eigenschaften
BearbeitenDie Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,53676, B = 1625,875 und C = −32,494 im Temperaturbereich von 2529 bis 391 K[30]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Verbrennungsenthalpie ΔcH0liquid −3534 kJ·mol−1[31] Wärmekapazität cp 240,2 J·mol−1·K−1 (17 °C)[32] als Flüssigkeit Kritische Temperatur Tc 561,5 K[33] Kritischer Druck pc 31,8 bar[33] Verdampfungsenthalpie ΔVH0 35,9 kJ·mol−1[34] beim Normaldrucksiedepunkt
Chemische Eigenschaften
BearbeitenEssigsäureisobutylester ist eine leicht entzündbare Flüssigkeit aus der Stoffgruppe der Carbonsäureester. In Wasser ist der Ester schwer löslich, in den gebräuchlichen organischen Lösungsmitteln jedoch gut. Außerdem ist die Flüssigkeit leicht flüchtig. Mit starken Oxidationsmitteln können explosive Reaktionen eintreten. Mit Alkalihydroxide oder Kalium-tert-butoxid reagiert Isobutylacetat ebenfalls heftig.[2]
Verwendung
BearbeitenDie Weltjahresproduktion von Isobutylacetat betrug im Jahr 2002 etwa 74.000 Tonnen.[35] Es wird als Lösungsmittel für Beschichtungsprozesse verwendet,[36] in Farben und Klebstoffen für den Modellbau[37] und gelegentlich in Nagellack.[38] Es wird außerdem als Duftstoff eingesetzt und hat einen durchdringenden Geruch nach Ananas und Banane.[29] Auch als Aromastoff findet es Verwendung; in der EU ist es unter der FL-Nummer 09.005 für Lebensmittel allgemein zugelassen.[39]
Essigsäureisobutylester wird als hervorragendes Lösungsmittel für Beschichtungsstoffe, Druckfarben und Lacke eingesetzt. Des Weiteren ist Isobutylacetat ein sehr gutes Lösemittel für Cellulosenitrat, Kolophonium und einige andere Naturharze, Polystyrol, Polyvinylacetate, Polyvinylether, Polyacrylsäureester und einige Copolymerisate des Vinylchlorids. Außerdem löst es modifizierte Phenolharze, Harnstoff- und Melamin-Harze, Keton- und Epoxidharze, ferner auch Fette und Öle. Nachchloriertes Polyvinylchlorid und Vinylacetat, Vinylchlorid, Dicarbonsäure-Copolymerisate sind etwas schwerer löslich, ebenso Chlorkautschuk. Naturkautschuk, Celluloseether und Polyvinylbutyrale werden nur gequollen. Praktisch unlöslich sind u. a. Schellack, Celluloseacetat, Celluloseacetobutyrat, Polyvinylformal, Polyvinylcarbazol und Wachse. Ganz besonders gut eingesetzt werden kann Isobutylacetat als Lösungsmittel für Nitrolacke, um die Viskosität herabzusetzen und die Verschneidfähigkeit zu erhöhen. Im Handel wird Isobutylacetat meist als Lösungsmittel-Gemisch mit 85 % Isobutylacetat und 15 % Isobutanol vertrieben.[3]
Sicherheitshinweise
BearbeitenDie Dämpfe von Isobutylacetat können mit Luft explosive Gemische bilden. Der Stoff wird hauptsächlich über den Atemtrakt und die Haut aufgenommen. Bei Aufnahme oder Exposition kommt es akut zu Reizungen der Augen und Atemwege. Bei höherer Konzentration kann eine Störung des Zentralnervensystems eintreten. Chronisch Folgen können Reizwirkungen auf Schleimhäute und Hautveränderungen sein. Eine Reproduktionstoxizität und Mutagenität konnte jedoch ausgeschlossen werden. Zur Kanzerogenität liegen keine ausreichenden Angaben vor. Isobutylacetat weist eine untere Explosionsgrenze (UEG) von ca. 1,25 Vol.-% (60 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 10,5 Vol.-% (510 g/cm3) auf. Der untere Explosionspunkt liegt bei 15 °C. Die Zündtemperatur beträgt 420 °C. Der Stoff fällt somit in die Temperaturklasse T2 und in die Explosionsgruppe IIA. Mit einem Flammpunkt von 18 °C gilt Isobutylacetat als leicht entflammbar.[2]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu ISOBUTYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- ↑ a b c d e f g h i j k l m n o p q r Eintrag zu Isobutylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b Eintrag zu Butylacetate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Juli 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-308.
- ↑ Eintrag zu Isobutyl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juli 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ R. Tressl, F. Drawert, W. Heimann, R. Emberger: Notizen: Gaschromatographische Bestandsaufnahme von Bananen-Aromastoffen. In: Zeitschrift für Naturforschung B. 24, 1969, S. 781–783 (online).
- ↑ María J. Jordán, Kawaljit Tandon, Philip E. Shaw, Kevin L. Goodner: Aromatic Profile of Aqueous Banana Essence and Banana Fruit by Gas Chromatography−Mass Spectrometry (GC-MS) and Gas Chromatography−Olfactometry (GC-O). In: Journal of Agricultural and Food Chemistry. Band 49, Nr. 10, 1. Oktober 2001, S. 4813–4817, doi:10.1021/jf010471k.
- ↑ María J. Jordán, Philip E. Shaw, Kevin L. Goodner: Volatile Components in Aqueous Essence and Fresh Fruit of Cucumis melo cv. Athena (Muskmelon) by GC-MS and GC-O. In: Journal of Agricultural and Food Chemistry. Band 49, Nr. 12, 1. Dezember 2001, S. 5929–5933, doi:10.1021/jf010954o.
- ↑ Javier M. Obando-Ulloa, Eduard Moreno, Jordi García-Mas, Bart Nicolai, Jeroen Lammertyn, Antonio J. Monforte, J. Pablo Fernández-Trujillo: Climacteric or non-climacteric behavior in melon fruit. In: Postharvest Biology and Technology. Band 49, Nr. 1, Juli 2008, S. 27–37, doi:10.1016/j.postharvbio.2007.11.004.
- ↑ Su Hwan Oh, Byung Seon Lim, Sae Jin Hong, Seung Koo Lee: Aroma volatile changes of netted muskmelon (Cucumis melo L.) fruit during developmental stages. In: Horticulture, Environment, and Biotechnology. Band 52, Nr. 6, Dezember 2011, S. 590–595, doi:10.1007/s13580-011-0090-z.
- ↑ T. Lavilla, J. Puy, M. L. López, I. Recasens, M. Vendrell: Relationships between Volatile Production, Fruit Quality, and Sensory Evaluation in Granny Smith Apples Stored in Different Controlled-Atmosphere Treatments by Means of Multivariate Analysis. In: Journal of Agricultural and Food Chemistry. Band 47, Nr. 9, 1. September 1999, S. 3791–3803, doi:10.1021/jf990066h.
- ↑ A. Rizzolo, C. Sodi, A. Polesello: Influence of ethylene removal on the volatile development in passa crassana pears stored in a controlled atmosphere. In: Food Chemistry. Band 42, Nr. 3, Januar 1991, S. 275–285, doi:10.1016/0308-8146(91)90070-5.
- ↑ Jorge Antonio Pino, Clara Elizabeth Quijano: Study of the volatile compounds from plum (Prunus domestica L. cv. Horvin) and estimation of their contribution to the fruit aroma. In: Food Science and Technology. Band 32, Nr. 1, 31. Januar 2012, S. 76–83, doi:10.1590/S0101-20612012005000006.
- ↑ David B. Katague, Ernst R. Kirch: Chromatographic Analysis of the Volatile Components of Papaya Fruit. In: Journal of Pharmaceutical Sciences. Band 54, Nr. 6, Juni 1965, S. 891–894, doi:10.1002/jps.2600540616.
- ↑ a b J. Cano-Salazar, M.L. López, C.H. Crisosto, G. Echeverría: Volatile compound emissions and sensory attributes of ‘Big Top’ nectarine and ‘Early Rich’ peach fruit in response to a pre-storage treatment before cold storage and subsequent shelf-life. In: Postharvest Biology and Technology. Band 76, Februar 2013, S. 152–162, doi:10.1016/j.postharvbio.2012.10.001.
- ↑ Peng-Fei Lu, Hai-Li Qiao, Zhi-Chun Xu, Jin Cheng, Shi-Xiang Zong, You-Qing Luo: Comparative analysis of peach and pear fruit volatiles attractive to the oriental fruit moth, Cydia molesta. In: Journal of Plant Interactions. Band 9, Nr. 1, 2. Januar 2014, S. 388–395, doi:10.1080/17429145.2013.843724.
- ↑ D.M. Modise: Does freezing and thawing affect the volatile profile of strawberry fruit (Fragaria×ananassa Duch.)? In: Postharvest Biology and Technology. Band 50, Nr. 1, Oktober 2008, S. 25–30, doi:10.1016/j.postharvbio.2008.03.009.
- ↑ Pablo Urbaneja-Bernat, Kevin Cloonan, Aijun Zhang, Paolo Salazar-Mendoza, Cesar Rodriguez-Saona: Fruit volatiles mediate differential attraction of Drosophila suzukii to wild and cultivated blueberries. In: Journal of Pest Science. Band 94, Nr. 4, September 2021, S. 1249–1263, doi:10.1007/s10340-021-01332-z.
- ↑ Peter K. C. Ong, Terry E. Acree: Gas Chromatography/Olfactory Analysis of Lychee ( Litchi chinesis Sonn.). In: Journal of Agricultural and Food Chemistry. Band 46, Nr. 6, 1. Juni 1998, S. 2282–2286, doi:10.1021/jf9801318.
- ↑ W Jennings: Volatile components of figs. In: Food Chemistry. Band 2, Nr. 3, Juli 1977, S. 185–191, doi:10.1016/0308-8146(77)90032-2.
- ↑ Taís Santos Sampaio, Paulo Cesar L. Nogueira: Volatile components of mangaba fruit (Hancornia speciosa Gomes) at three stages of maturity. In: Food Chemistry. Band 95, Nr. 4, April 2006, S. 606–610, doi:10.1016/j.foodchem.2005.01.038.
- ↑ Natalia Conde-Martínez, Diana Cristina Sinuco, Coralia Osorio: Chemical studies on curuba (Passiflora mollissima (Kunth) L. H. Bailey) fruit flavour. In: Food Chemistry. Band 157, August 2014, S. 356–363, doi:10.1016/j.foodchem.2014.02.056.
- ↑ T. Shoko, Z. Apostolides, M. Monjerezi, J.D.K. Saka: Volatile constituents of fruit pulp of Strychnos cocculoides (Baker) growing in Malawi using solid phase microextraction. In: South African Journal of Botany. Band 84, Januar 2013, S. 11–12, doi:10.1016/j.sajb.2012.09.001.
- ↑ Bangzhu Peng, Fuling Li, Lu Cui, Yaodong Guo: Effects of Fermentation Temperature on Key Aroma Compounds and Sensory Properties of Apple Wine. In: Journal of Food Science. Band 80, Nr. 12, Dezember 2015, doi:10.1111/1750-3841.13111.
- ↑ Luchai Butkhup, Montri Jeenphakdee, Sujitar Jorjong, Supachai Samappito, Wannee Samappito, Sawitree Chowtivannakul: HS-SPME-GC-MS analysis of volatile aromatic compounds in alcohol related beverages made with mulberry fruits. In: Food Science and Biotechnology. Band 20, Nr. 4, August 2011, S. 1021–1032, doi:10.1007/s10068-011-0140-4.
- ↑ a b Patent DE69907653T2: Verfahren und Einrichtung zum Herstellen von Butylacetat und Isobutylacetat. Angemeldet am 11. März 1999, veröffentlicht am 4. Oktober 2007, Anmelder: Sulzer Chemtech AG, Erfinder: Jaromir Lederer, Jiri Kolena, Jiri Hanika, Pavel Moravek, Quido Smejkal, Vladimir Macek, Wiekert Willem Levering, Oliver Bailer.
- ↑ Klaus Schwetlick u. a.: Organikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- ↑ H. Cheung, R. S. Tanke, G. P. Torrence: Acetic Acid. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a01_045.
- ↑ a b D. Stoye: Solvents. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005, doi:10.1002/14356007.a24_437
- ↑ D. R. Stull: Vapor Pressure of Pure Substances Organic Compounds. In: Industrial & Engineering Chemistry Research 39, 1947, S. 517–540.
- ↑ E. Schjanberg: Die Verbrennungswarmen und die Refraktionsdaten einiger chlorsubstituierter Fettsauren und Ester. In: Z. Phys. Chem. Abt. A. 172, 1935, S. 197–233.
- ↑ N. S. Kurnakov, N. K. Voskresenskaya: Calorimetry of liquid binary systems. In: Izv. Akad. Nauk SSSR, Otdel. Mat. i Estestv. Nauk. Ser. Khim. 1936, S. 439–461.
- ↑ a b A. Nadezhdin In: Rep. Phys. 23, 1887, S. 708.
- ↑ J. H. Mathews: The accurate measurement of heats of vaporization of liquids. In: J. Am. Chem. Soc. 48, 1926, S. 562–576, doi:10.1021/ja01414a002.
- ↑ sec-butyl Acetate. In: Hawley's Condensed Chemical Dictionary. John Wiley & Sons, Inc., Hoboken, NJ, USA 15. März 2007.
- ↑ Stout, R. L. "Solvents in today’s coatings." Applied Polymer Science: 21st Century (2000): 527-543.
- ↑ Jun Saito, Masayuki Ikeda: Solvent constituents in paint, glue and thinner for plastic miniature hobby. In: The Tohoku Journal of Experimental Medicine. Band 155, Nr. 3, 1988, S. 275–283, doi:10.1620/tjem.155.275.
- ↑ Eeva-Liisa Sainio, Kerstin Engström, Maj-Len Henriks-Eckerman, Lasse Kanerva: Allergenic ingredients in nail polishes. In: Contact Dermatitis. Band 37, Nr. 4, Oktober 1997, S. 155–162, doi:10.1111/j.1600-0536.1997.tb00189.x.
- ↑ Food and Feed Information Portal Database. In: ec.europa.eu. Abgerufen am 18. Oktober 2023 (englisch).

