F-53B
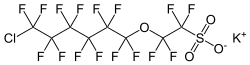
F-53B ist das Kaliumsalz einer Perhalogensulfonsäure und gehört zu den per- und polyfluorierten Alkylverbindungen (PFAS) sowie den Chlor-substituierten Perfluoralkylethersulfonsäuren (Cl-PFESA).
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | F-53B | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C8ClF16KO4S | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 570,67 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Verwendung
BearbeitenF-53B wird seit den Siebzigerjahren als Antischleiermittel (Nebelunterdrücker) in der chinesischen Galvanotechnik bei der Verchromung eingesetzt.[3] Gegenüber F-53, das voll fluoriert ist, bestehen preisliche Vorteile in der Synthese. In der Wasseraufbereitung verhält es sich ähnlich wie das Anion der Perfluoroctansulfonsäure (PFOS).[3] Seit 1982 kommen auch PFOS-Salze zum Einsatz.[3]
Gefahren- und Risikobeurteilung
BearbeitenF-53B hat eine ähnlich starke Bindungsaffinität zum Leber-Fettsäurebindungsprotein wie PFOS,[4] welches bioakkumulativ ist und in das Stockholmer Übereinkommen aufgenommen wurde. Zudem weist F-53B eine mindestens gleich hohe Toxizität auf wie PFOS.[4][3][5] Es wurde u. a. im Blutserum von Neugeborenen und in Fischottern aus England gefunden.[6][7]
Siehe auch
Bearbeiten- Perfluoroctansäure (PFOA)
Einzelnachweise
Bearbeiten- ↑ Fangfang Chen, Shanshan Yin, Barry C. Kelly, Weiping Liu: Chlorinated Polyfluoroalkyl Ether Sulfonic Acids in Matched Maternal, Cord, and Placenta Samples: A Study of Transplacental Transfer. In: Environmental Science & Technology. 51(11), 2017, S. 6387–6394, doi:10.1021/acs.est.6b06049.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c d Siwen Wang, Jun Huang, Yang Yang, Yamei Hui, Yuxi Ge, Thorjørn Larssen, Gang Yu, Shubo Deng, Bin Wang, Christopher Harman: First Report of a Chinese PFOS Alternative Overlooked for 30 Years: Its Toxicity, Persistence, and Presence in the Environment. In: Environmental Science & Technology. 47(18), 2013, S. 10163–10170, doi:10.1021/es401525n.
- ↑ a b Weixiao Cheng, Carla A. Ng: Predicting Relative Protein Affinity of Novel Per- and Polyfluoroalkyl Substances (PFASs) by An Efficient Molecular Dynamics Approach. In: Environmental Science & Technology. 52(14), 2018, S. 7972–7980, doi:10.1021/acs.est.8b01268.
- ↑ Nan Sheng, Ruina Cui, Jinghua Wang, Yong Guo, Jianshe Wang, Jiayin Dai: Cytotoxicity of novel fluorinated alternatives to long-chain perfluoroalkyl substances to human liver cell line and their binding capacity to human liver fatty acid binding protein. In: Archives of Toxicology. 92(1), 2018, S. 359–369, doi:10.1007/s00204-017-2055-1.
- ↑ Yingxue Liu, Xuji Zhou, Yiting Wu, Xiaomeng Yang, Yanting Wang, Shuai Li, Xiaoxia Bai, Daniel Schlenk, Weiping Liu: Exposure and Blood–Cerebrospinal Fluid Barrier Permeability of PFASs in Neonates. In: Environmental Science & Technology Letters. 15. Dezember 2021, doi:10.1021/acs.estlett.1c00862.
- ↑ Andreas Androulakakis et al.: Determination of 56 per- and polyfluoroalkyl substances in top predators and their prey from Northern Europe by LC-MS/MS. In: Chemosphere. Band 287, 2022, S. 131775, doi:10.1016/j.chemosphere.2021.131775.