Methylzinntrichlorid
Methylzinntrichlorid ist eine chemische Verbindung aus der Gruppe der zinnorganischen Verbindungen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
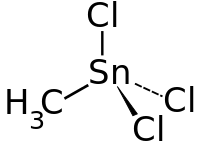
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methylzinntrichlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3Cl3Sn | |||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 240,1 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,5 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
171 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
leicht in Wasser (1038 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,004 ml·m−3, 0,02 mg·m−3 (Mono- und Dimethylzinnverbindungen)[2] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung Bearbeiten
Methylzinntrichlorid kann durch Umsetzung von Zinndichlorid mit Methylchlorid in Gegenwart eines Katalysators, wie Tetraphenylphosphoniumchlorid, oder Antimontrichlorid hergestellt werden:[6][7]
Auch kann es ohne Katalysator in hoher Ausbeute aus Zinndichlorid und Methylchlorid in einer Natriumtetrachloroaluminat-Salzschmelze bei 280 °C hergestellt werden. Gegenüber der direkten Umsetzung von geschmolzenem Zinndichlorid mit Methylchlorid ergibt sich durch die Verwendung der Salzschmelze eine höhere Reaktivität und Selektivität:.[8][9]
Eigenschaften Bearbeiten
Methylzinntrichlorid ist ein brennbarer, feuchtigkeitsempfindlicher Feststoff mit einem Flammpunkt von 41 °C.[1] Im 119Sn-NMR-Spektrum zeigt es ein Signal bei +21 ppm.[10] Es hat in Benzol ein Dipolmoment von 3,77 Debye.[3]
Sicherheitshinweise/Toxizität Bearbeiten
Methylzinntrichlorid ist wie viele andere organische Zinnverbindungen als giftig eingestuft und muss daher mit entsprechender Vorsicht gehandhabt werden. Die toxischen Wirkung zielt insbesondere auf die Nieren und das zentrale Nervensystem, in höherer Dosis auch auf Leber, Nebennieren, Thymus, Milz, Harnblase, Hoden und Nebenhoden.[2]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g h Datenblatt Methyltin trichloride, 97% bei Sigma-Aldrich, abgerufen am 8. Mai 2015 (PDF).
- ↑ a b c d e Methylzinnverbindungen. In: DFG (Hrsg.): The MAK Collection for Occupational Health and Safety. 2014, S. 3–9, doi:10.1002/3527600418.mb744031metd0056.
- ↑ a b Jörg Lorberth, Heinrich Nöth: Dipolmomente einiger Organozinnchloride. In: Chemische Berichte. Band 98, Nr. 3, März 1965, S. 969, doi:10.1002/cber.19650980342.
- ↑ a b Eintrag zu Trichlormethylstannan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ Eintrag zu Trichloromethylstannane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Patent US3519667: Process for preparing mono-methyl or ethyltin trichloride. Veröffentlicht am 29. März 1968, Erfinder: Hechenbleikner Ingenuin, Molt Kenneth R.
- ↑ Didier Astruc: Organometallic Chemistry and Catalysis. Springer Science & Business Media, 2007, ISBN 978-3-540-46129-6, S. 336 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ W. Lutz, W. Sundermeyer, W. Towae: Chemische Reaktionen in Salzschmelzen. XVIII. Die Synthese des Methylzinntrichlorids, CH3SnCl3. In: Zeitschrift für anorganische und allgemeine Chemie. Band 444, Nr. 1, September 1978, S. 21–29, doi:10.1002/zaac.19784440102.
- ↑ A. v. Rumohr, W. Sundermeyer, W. Towae: Chemische Reaktionen in Salzschmelzen. XIX. Zur Direktsynthese des Dimethylzinndichlorids, (CH3)2SnCl2. In: Zeitschrift für anorganische und allgemeine Chemie. Band 499, Nr. 4, April 1983, S. 75–80, doi:10.1002/zaac.19834990409.
- ↑ Christoph Elschenbroich: Organometallchemie. 4. Auflage. TB. G. Teubner, Stuttgart / Leipzig / Wiesbaden 2003, ISBN 978-3-322-99393-9, S. 174, doi:10.1007/978-3-322-99393-9.


