Carbonsäuren
| Carbonsäuren |
|---|
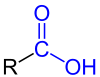
|
| Allgemeine Struktur der Monocarbonsäuren mit der blau markierten Carboxy-Funktion. Der Rest R stellt dabei entweder ein Wasserstoffatom oder eine Organylgruppe dar. |
Carbonsäuren,[1] auch Karbonsäuren,[2] sind organische Verbindungen, die eine oder mehrere Carboxygruppen (–COOH) tragen und damit einen mehr oder weniger ausgeprägten aciden Charakter haben. Die Salze von Carbonsäuren werden Carboxylate genannt. Verbindungen, in denen die OH-Gruppe der Carboxygruppe durch eine andere Gruppe – z. B. –OR, –NH2 oder ein Halogenid – ersetzt ist, werden Carbonsäurederivate genannt. Zu den Carbonsäurederivaten gehören damit Carbonsäureester, Carbonsäureamide und Carbonsäurehalogenide.[3]
Nomenklatur Bearbeiten
Für die systematische Benennung der Carbonsäuren im Deutschen wird dem Namen des Grundgerüsts der Wortbestandteil „-säure“ angehängt. Viele Carbonsäuren tragen daneben unsystematische Namen (Trivialnamen), die ebenfalls mit „-säure“ enden. Beispiele für Bezeichnungen von Carbonsäuren mit dem Grundgerüst eines Alkans sind Methansäure (Ameisensäure), Ethansäure (Essigsäure) und Butansäure (Buttersäure). Der Trivialname kennzeichnet die jeweilige Carbonsäure zumeist nach einem typischen Vorkommen.
Einteilung Bearbeiten
Nach der chemischen Struktur des Rests R, an welchen die Gruppe –COOH gebunden ist, unterscheidet man zwischen aliphatischen, aromatischen und heterocyclischen Carbonsäuren. Die aliphatischen Carbonsäuren lassen sich weiter in Alkansäuren, Alkensäuren und Alkinsäuren unterteilen. Alkansäuren werden auch gesättigte Carbonsäuren genannt. Alkensäuren, also Carbonsäuren mit mindestens einer Doppelbindung im Rest (z. B. Acrylsäure) und Alkinsäuren, mit mindestens einer Dreifachbindung im Rest, werden dagegen als ungesättigte Carbonsäuren bezeichnet.
Weiterhin lassen sich Carbonsäuren nach Anzahl der enthaltenen Carboxygruppen unterscheiden. Monocarbonsäuren haben eine Carboxygruppe, während Dicarbonsäuren (z. B. Oxalsäure) zwei und Tricarbonsäuren (z. B. Citronensäure) drei Carboxygruppen enthalten.[3]
Außerdem gibt es Gruppen von Carbonsäuren, die neben der Carboxygruppe noch weitere funktionelle Gruppen tragen, so die Ketocarbonsäuren, die Hydroxycarbonsäuren (z. B. Milchsäure) und die Aminosäuren (eigentlich: Aminocarbonsäuren).
Unter dem Gesichtspunkt der chemischen Struktur sind die sogenannten Fettsäuren keine besondere Gruppe der Carbonsäuren, denn es handelt sich bei ihnen um meist unverzweigte, aliphatische, gesättigte oder ungesättigte Monocarbonsäuren, häufig mit 12 bis 22, manchmal, wie in der Butter, auch mit nur 4 Kohlenstoffatomen. Sie liegen dort verestert mit Glycerin als sog. Triglyceride in den tierischen und pflanzlichen Fetten vor (siehe z. B. Milchfett). Neuere Erkenntnisse haben ergeben, dass in den fettartigen Lipiden von Zellmembranen auch kürzerkettige und verzweigte Carbonsäuren vorkommen, so dass heute unter dem Begriff Fettsäure alle Carbonsäuren mit (kettenförmigen) Organylgruppen zusammengefasst werden können.
Eine weitere nach dem Vorkommen bezeichnete Gruppe von Carbonsäuren sind die Harzsäuren, die in Naturharzen vorkommen.
Unter dem Gesichtspunkt der chemischen Struktur gehören die sog. Metallacarbonsäuren nicht in die Gruppe der Carbonsäuren. So bezeichnet werden Metall-Komplexe mit Carboxyliganden die als Zwischenprodukte in (katalysierten) Reaktionen mit Kohlenstoffmonoxid (CO) und Kohlenstoffdioxid (CO2) auftreten, etwa bei der Wassergas-Shift-Reaktion.
Beispiele Bearbeiten
| aliphatische, gesättigte Monocarbonsäuren |
Essigsäure | Buttersäure (eine Fettsäure) |
||
| aliphatische, ungesättigte Monocarbonsäuren |
Acrylsäure | Ölsäure (eine Fettsäure) |
||
| aliphatische, gesättigte Dicarbonsäuren |
Oxalsäure | Bernsteinsäure | ||
| aliphatische, gesättigte Tricarbonsäuren |
Citronensäure | Agaricinsäure | ||
| aliphatische, ungesättigte Dicarbonsäuren |
Fumarsäure | Maleinsäure | ||
| aromatische Carbonsäuren |
Benzoesäure | Salicylsäure | ||
| heterocyclische Carbonsäuren |
Nicotinsäure | Pyrrolidin-2-carbonsäure (eine Aminosäure) |
||
| aliphatische, ungesättigte, cyclische Monocarbonsäuren |
Abietinsäure (eine Harzsäure) |
Gibberellinsäure |
Eigenschaften Bearbeiten
Die chemischen Eigenschaften von Carbonsäuren ohne zusätzliche funktionelle Gruppen in der Alkylkette werden allein von der Carboxygruppe bestimmt. Das Sauerstoffatom der Carbonylgruppe (C=O) hat einen relativ starken elektronenziehenden Effekt, sodass die Bindung zwischen Wasserstoff und dem Sauerstoffatom der Hydroxygruppe stark polarisiert wird. Das fördert die Freisetzung von H+-Ionen aus der Carboxygruppe, hier anhand von Essigsäure dargestellt:
Zusätzlich ist der saure Charakter der Carbonsäuren eine Folge der Mesomeriestabilisierung des Carboxylat-Anions. Sie begünstigt die deprotonierte Form der Carbonsäure und damit die Stabilität des Anions. Ähnlich wie bei der Mesomerie-Stabilisierung des Benzols deutet man das delokalisierte Elektron oft mit der folgenden Schreibweise an (Im Beispiel steht R für die Methylgruppe CH3).
Die physikalischen Eigenschaften von Carbonsäuren (Säurestärke, Siedepunkt, bzw. Schmelzpunkt, Löslichkeit in Wasser) werden wesentlich von der Art der Alkylkette und von eventuell vorhandenen Substituenten in der Alkylgruppe bestimmt.
Die Acidität einer Carbonsäure ist umso stärker ausgeprägt, je kürzer die Alkylkette ist. Ein zusätzlich am Alpha-C-Atom vorhandener Substituent mit einem elektronenziehenden induktivem Effekt (−I-Effekt), steigert die Säurestärke erheblich. Der Carboxygruppe wird eine positivere Partialladung zugeführt, welche die negative Ladung des Anions stärker ausgleichen und damit das Anion stabilisieren kann. Ein Beispiel dafür ist das stabilere Trichloracetat im Vergleich zum Acetat. Ein Maß für die Säurestärke einer Carbonsäure ist die Säurekonstante bzw. der pKs-Wert.
Kurzkettige Carbonsäuren mit bis zu sechs C-Atomen sind farblose, stechend (Ameisensäure) bzw. unangenehm (Buttersäure) riechende Flüssigkeiten mit relativ hohen Siedepunkten. Carbonsäuren haben durch die Carboxygruppe einen polaren Charakter, was eine gute Löslichkeit in Wasser zur Folge hat, die mit zunehmender Länge der Alkylkette abnimmt. Die gut mögliche räumliche Anordnung von zwei Carboxygruppen begünstigt die Ausbildung von intermolekularen Wasserstoffbrückenbindungen und führt damit zu Carbonsäuredimeren. Die doppelte Masse der Teilchen im Dampfraum über der Flüssigkeit kann die relativ hohen Siedepunkte von Carbonsäuren erklären.
Mit zunehmender Kettenlänge nimmt der lipophile Charakter von Carbonsäuren zu und der hydrophile Charakter ab. Das gilt auch für die Salze der Carbonsäuren. Die Salze haben aber neben der lipophilen Alkylkette, mit eventuell mehr als sechs Kohlenstoffatomen, mit der Carboxylat-Gruppe auch eine hydrophile Gruppe im gleichen Molekül. Die Natrium- und Kaliumsalze der langkettigen Carbonsäuren sind also amphiphile Substanzen. Sie haben die Eigenschaften von Tensiden und werden als Kernseifen und Schmierseifen verwendet.
Herstellung Bearbeiten
Oxidationen Bearbeiten
Carbonsäuren können immer nur dann durch Oxidationsreaktionen mit starken Oxidationsmitteln aus Alkanen oder aus mit Alkylgruppen substituierten aromatischen Kohlenwasserstoffen hergestellt werden, wenn keine anderen oxidierbaren funktionellen Gruppen im Molekül vorhanden sind, die auch oxidiert werden können, wie z. B. Hydroxyl- oder Aminogruppen oder C–C-Doppelbindungen, Zwischenstufen der vollständigen Oxidation von Alkylgruppen sind Alkohole, und Aldehyde, die deshalb auch selbst als Ausgangssubstanzen für Oxidationsreaktionen eingesetzt werden können. Bekannte geeignete Oxidationsmittel sind Sauerstoff, oder gar Ozon, Kaliumpermanganat, Chromtrioxid, Salpetersäure oder Kaliumdichromat.
- Oxidation von Alkanen: Ein ab 1930 in Deutschland industriell betriebenes Verfahren war die sogenannte Paraffinoxidation. Dabei wurden Gemische von längerkettigen Alkanen, mit Luftsauerstoff und Permanganaten bei 120 °C. behandelt. Durch oxidative Spaltungen der Alkanketten entstanden Gemische verschiedener Carbonsäuren, die aufgetrennt werden mussten. Als Nebenprodukte entstanden Alkohole und Aldehyde.[4] Die folgende zugehörige Reaktionsgleichung und alle folgenden Reaktionsgleichungen für Oxidationsreaktionen sind schematisch vereinfacht.
- Oxidation von alkylierten Aromaten:
- Oxidation von Olefinen mit basischem Kaliumpermanganat. Unter neutralen Bedingungen führt die Reaktion nur zu vicinalen Diolen.
Reaktionen mit Verlängerung der Alkylkette Bearbeiten
- Reaktion von Grignard-Verbindungen, vorher gebildet aus Halogenalkanen, mit Kohlenstoffdioxid. Die anschließende Zugabe von Wasser führt zur freien Carbonsäure. (Reaktionsgleichung fasst beide Schritte schematisch zusammen).
- Wenn in der Alkylkette funktionelle Gruppen vorhanden sind, die die Herstellung einer Grignard-Verbindung verhindern, muss ein Umweg
- über die Kolbe-Nitrilsynthese und anschließende Hydrolyse des Nitrils gewählt werden. (Reaktionsgleichung zeigt beide Schritte zusammengefasst nur schematisch)
Hydrolyse von Carbonsäurederivaten Bearbeiten
- Die Hydrolyse von sog. reaktiven Carbonsäurederivaten, z. B. Carbonsäurechloriden oder Carbonsäureanhydriden ergibt keinen Sinn, da reaktive Carbonsäurederivate zunächst immer erst aus Carbonsäuren hergestellt werden müssen, um dann aus ihnen andere, weniger reaktive Carbonsäurederivate herstellen zu können. Deshalb handelt es sich bei Hydrolysereaktionen von reaktiven Carbonsäurederivaten meist um unerwünschte Nebenreaktionen, die dadurch vermieden werden können, dass unter Ausschluss von Wasser und Luftfeuchtigkeit gearbeitet wird.
- Dagegen handelt es sich bei der alkalischen Hydrolyse (auch „Verseifung“ genannt) oder bei der sauer katalysierten Hydrolyse von nicht reaktiven Carbonsäurederivaten, wie z. B Carbonsäureestern oder Carbonsäureamiden um erwünschte bzw. geplante Hydrolysereaktionen:
- Die saure oder basische Hydrolyse von Carbonsäureamiden muss sogar wegen der Stabilität der Carbonsäureamide unter energischen Bedingungen erfolgen.
- Auch die saure oder basische Hydrolyse von Nitrilen muss wegen der Stabilität der Nitrile unter energischen Bedingungen erfolgen.
Sonstige spezielle Reaktionen Bearbeiten
- Kolbe-Schmitt-Reaktion: zur Synthese von Hydroxybenzoesäuren (z. B. Salicylsäure) aus Phenolaten und Kohlendioxid
- Benzilsäure-Umlagerung: aus 1,2-Diketonen werden α-Hydroxycarbonsäuren
- Koch-Reaktion (Hydroformylierung): aus verzweigten Alkenen werden durch Anlagerung von Kohlenmonoxid am α-C-Atom stark verzweigte Carbonsäuren
Spektroskopie von Carbonsäuren Bearbeiten
Die wichtigsten analytischen Methoden zur Strukturaufklärung von Carbonsäuren sind die IR- und NMR-Spektroskopie.
Im IR-Spektrum sind die C=O-Valenzschwingung bei etwa 1710–1760 cm−1 und die breite OH-Valenzschwingung um 3000 cm−1 charakteristisch.
Im 1H-NMR-Spektrum sind die aciden Hydroxy-Protonen zu ungewöhnlich niedrigem Feld verschoben, 10–13 ppm. Die Protonen der Alkylgruppen am Carbonyl-C haben eine chemische Verschiebung im Bereich von ca. 2,0–2,5 ppm; das direkt an die Carbonylgruppe gebundene H-Atom der Ameisensäure erscheint bei 8,08 ppm. In einer C-Kette einer nicht konjugierten Carbonsäure sind die Peaks, die weiter von der Carbonylfunktion entfernt sind, mit zunehmendem Maße weniger stark zu tiefem Feld verschoben, weil der Einfluss des induktiven Effekts der Carbonylgruppe abnimmt.
Im 13C-NMR-Spektrum findet man das Carboxy-C-Atom im Bereich von zirka 170 bis 180 ppm.
Wichtige Reaktionen Bearbeiten
Wegen der beiden dem C-Atom der Carboxygruppe benachbarten Sauerstoffatome, die elektronenziehend wirken, können nucleophile Angriffe auf das Kohlenstoffatom der Carboxygruppe stattfinden. Der nucleophile Angriff kann durch Säurekatalyse (Protonierung der Carbonylgruppe) gefördert werden, wenn die angreifenden Nucleophile keine starken Brønsted-Basen sind, wie z. B. Alkohole. Wenn die Nucleophile Basen sind, wie z. B. Ammoniak oder Amine werden sie durch die Säurekatalyse protoniert und geschwächt. Auch ohne Säurekatalyse werden solche Nucleophile durch die Carbonsäure selbst protoniert und unwirksam. Gleichzeitig entstehen auch die entsprechenden Salze der Carbonsäure, die nicht mehr nucleophil angreifbar sind.
Veresterung Bearbeiten
Bei der säurekatalysierten Veresterung reagiert die Carboxyl-Gruppe einer organischen Säure mit der Hydroxygruppe eines Alkohols. Unter Abspaltung von Wasser entsteht ein Ester. Im Laufe der Reaktion setzt eine Rückreaktion ein, denn auch die Carboxygruppe im entstandenen Ester kann durch das entstandene Wasser nucleophil angegriffen werden. Nach Abspaltung des Alkohols wird dann die ursprüngliche Säure zurückgebildet. Wenn R1 der Rest der Säure, und R2 der Rest des Alkohols ist, stellt sich im Laufe der Reaktion die folgende Gleichgewichtsreaktion ein:
Die Lage des Gleichgewichts kann beeinflusst werden. Wenn der gebildete Ester einen niedrigeren Siedepunkt hat als die Säure kann er durch kontinuierliche Abdestillation gewonnen werden. Ein Zusatz von festen Trocknungsmitteln, die Wasser binden können, lässt die Esterbildung vollständiger verlaufen.
Dehydratisierung Bearbeiten
Carbonsäuren können theoretisch leicht unter intermolekularer Wasserabspaltung (Dehydratisierung) bei höheren Temperaturen in organische Carbonsäureanhydride umgewandelt werden. In der Laborpraxis gelingt diese Reaktion wohl nur selten, denn bei hohen Temperaturen kann auch intramolekulare Wasserabspaltung eintreten, wobei sich Ketene bilden.
Eine Alternative zur Bildung von Carbonsäureanhydriden aus Carbonsäuren ist der Zusatz von stark wasserentziehenden Substanzen (Phosphorpentoxid) oder andere Reaktionen, wie die Umsetzung von Carbonsäurehalogeniden mit den Salzen von Carbonsäuren, oder die Umsetzung von Ketenen mit Carbonsäuren.
Carbonsäureanhydride können mit Wasser wieder zu den entsprechenden Carbonsäuren zurück reagieren.
Weblinks Bearbeiten
Einzelnachweise Bearbeiten
- ↑ Carbonsäure bei Duden.de, abgerufen am 15. Januar 2016.
- ↑ Karbonsäure bei Duden.de, abgerufen am 15. Januar 2016.
- ↑ a b Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag, Leipzig 1965, S. 645–646.
- ↑ G. Wietzel: Herstellung synthetischer Fettsäuren durch Oxydation von paraffinischen Kohlenwasserstoffen mit molekularem Sauerstoff. In: Chemical Engineering Science. 3, 1954, S. 17–IN4, doi:10.1016/S0009-2509(54)80003-0.