Sulforaphan
Sulforaphan, chemisch 1-Isothiocyanato-4-methylsulfinyl-butan, ist ein Isothiocyanat. Das Senföl entsteht bei der enzymatischen Hydrolyse des Senfölglykosids Glucoraphanin.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
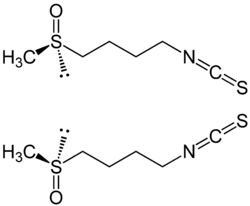
| ||||||||||
| (R)-Sulforaphan (oben) und (S)-Sulforaphan (unten) | ||||||||||
| Allgemeines | ||||||||||
| Name | Sulforaphan | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C6H11NOS2 | |||||||||
| Kurzbeschreibung |
leicht gelbliche Flüssigkeit[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 177,29 g·mol−1 | |||||||||
| Siedepunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Eigenschaften und Vorkommen
BearbeitenSulforaphan ist ein starkes indirektes Antioxidans.[4] Es wurde erstmals 1992 von Paul Talalay und Kollegen an der Johns-Hopkins-Universität in Baltimore isoliert und beschrieben.[5]
Der sekundäre Pflanzenstoff kommt als Senfölglykosid-Glucoraphanin insbesondere in Kreuzblütengewächsen wie Kohl und Broccoli vor. Im Unterschied zu Vitamin C, Vitamin E oder β-Carotin neutralisiert der Wirkstoff freie Radikale nicht direkt, sondern indirekt, indem es Phase-II-Enzyme aktiviert. Hierdurch werden nachhaltige antioxidative Abwehrmechanismen des Körpers in Gang gesetzt.[6]
Wirkung auf Krebszellen
BearbeitenIn verschiedenen Studien konnte sowohl in der Zellkultur als auch in Tierversuchen eine Tumorzellen hemmende Wirkung von Sulforaphan nachgewiesen werden. Hierbei sollen bestimmte Komponenten von sich teilenden Krebszellen, die sogenannten Mikrotubuli, von Sulforaphan zerstört werden, was zum Niedergang der Krebszelle führt. Derzeit (Stand September 2012) befindet sich Sulforaphan in einer Vielzahl klinischer Studien.[7] So unter anderem in einer Phase-II-Studie zur Behandlung des Prostatakarzinoms, deren klinischer Hauptendpunkt nicht erzielt wurde.[8][9]
In neueren experimentellen Studien (2011) vom Universitätsklinikum Heidelberg und Deutschen Krebsforschungszentrum konnte gezeigt werden, dass der Inhaltsstoff Sulforaphan aus Broccoli und verwandtem Gemüse im Zell- und Tiermodell das Krebswachstum von Bauchspeicheldrüsenkrebs hemmen kann und die Wirkung von Chemotherapien verstärkt. Sulforaphan blockiert hierbei einen bestimmten Stoffwechselweg in Krebsstammzellen, was erstmals in Versuchen an Krebszellen und Mäusen gezeigt werden konnte.[10] Eine klinische Studie an Menschen existiert hierzu nicht.
Nach einer kanadischen Studie soll bei Patienten mit Prostatakarzinom der wöchentliche Verzehr von Broccoli oder Blumenkohl die Metastasierung des Tumors um 50 Prozent verringern.[11]
Wirkung auf Helicobacter pylori
BearbeitenZudem soll der Wirkstoff keimtötend gegen den Magengeschwür-Verursacher Helicobacter pylori wirken, auch gegen Stämme, die gegen gängige Antibiotika Resistenzen gebildet haben.[12][13][14][15][16] Andere Studien bezweifeln die Wirksamkeit.[17]
Wirkung auf Blutfette
BearbeitenSulforaphan wirkt in Tierstudien (Kontext high-fat-Diät) günstig auf Körpergewicht, Lebergewicht, Gesamtcholesterin, LDL-Cholesterin und Triglyceride, aber nicht HDL.[18] In zwei Humanstudien wurden ähnliche Effekte für LDL-Cholesterin gefunden, aber seither nicht repliziert.[19] Eine Humanstudie zur Leberfunktion beschrieb eine Verbesserung der Leberenzymwerte unter Supplementation mit Sulforaphan.[20]
Wirkung auf Verhaltensmerkmale bei Autismus
BearbeitenSulforaphan wurde in mehreren klinischen Studien darauf untersucht, ob es psychische Symptome bei Autismus verbessern kann. Hier zeigten sich in einigen Testreihen keine relevanten Effekte,[21][22] obwohl andere Studien eine Wirkung z. B. auf Reizbarkeit beschrieben.[23][24]
Wirkung auf entzündliche Atemwegserkrankungen
BearbeitenFür Sulforaphan wird ein Wirkmechanismus am Transkriptionsfaktor NRF2 diskutiert; dieser ist an entzündlichen Reaktionen der Atemwege beteiligt. Eine tatsächliche Wirkung ist bislang nicht nachgewiesen.[25][26]
Analytik
BearbeitenDie sichere qualitative und quantitative Bestimmung gelingt nach angemessener Probenvorbereitung durch Kopplung der HPLC mit der Massenspektrometrie.[27][28][29][30]
Metabolismus
BearbeitenDer Abbau und die Ausscheidung von Sulforaphan geschieht in Säugetieren hauptsächlich mittels einer Glutathion-S-Transferase, indem es zu einem Dithiocarbamat umgesetzt wird, dabei wird die Thiolgruppe des Glutathions an die Isothiocyanatgruppe des Sulforaphans addiert. Nach der enzymatischen Abspaltung der Glutaminsäure und des Glycins wird durch Acetylierung ein N-Acetylcystein-Addukt gebildet, welches in Tierversuchen an Ratten (zusammen mit dem Glutathion-Addukt) in Urin und Galle gefunden werden konnte. Sulforaphan kann auch zu seinem Thioether-Analogon Erucin reduziert werden, die genauen Mechanismen dazu sind bislang noch ungeklärt.[31]
Literatur
Bearbeiten- B. M. Kaminski, D. Steinhilber u. a.: Phytochemicals resveratrol and sulforaphane as potential agents for enhancing the anti-tumor activities of conventional cancer therapies. In: Current Pharmaceutical Biotechnology. Band 13, Nummer 1, Januar 2012, S. 137–146, PMID 21466425. (Review).
- Y. S. Keum: Regulation of the Keap1/Nrf2 system by chemopreventive sulforaphane: implications of posttranslational modifications. In: Annals of the New York Academy of Sciences. Band 1229, Juli 2011, S. 184–189, doi:10.1111/j.1749-6632.2011.06092.x. PMID 21793854. (Review).
- C. W. Beecher: Cancer preventive properties of varieties of Brassica oleracea: a review. In: The American journal of clinical nutrition. Band 59, Nummer 5 Suppl, 1994, S. 1166S–1170S, PMID 8172118. (Review). PDF (freier Volltextzugriff, auf Englisch)
- C. Fimognari, P. Hrelia: Sulforaphane as a promising molecule for fighting cancer. In: Mutation Research. Band 635, Nummer 2–3, 2007, S. 90–104, doi:10.1016/j.mrrev.2006.10.004. PMID 17134937. (Review).
- N. Juge, R. F. Mithen, M. Traka: Molecular basis for chemoprevention by sulforaphane: a comprehensive review. In: Cellular and molecular life sciences. Band 64, Nummer 9, 2007, S. 1105–1127, doi:10.1007/s00018-007-6484-5. PMID 17396224. (Review).
Einzelnachweise
Bearbeiten- ↑ Eintrag zu SULFORAPHANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Oktober 2021.
- ↑ a b c d Datenblatt DL-Sulforaphane bei Sigma-Aldrich, abgerufen am 29. Mai 2011 (PDF).
- ↑ Eintrag zu Senföle. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ C. E. Guerrero-Beltrán, M. Calderón-Oliver u. a.: Protective effect of sulforaphane against oxidative stress: recent advances. In: Experimental and Toxicologic Pathology. Band 64, Nummer 5, Juli 2012, S. 503–508, doi:10.1016/j.etp.2010.11.005. PMID 21129940.
- ↑ Y. Zhang, P. Talalay u. a.: A major inducer of anticarcinogenic protective enzymes from broccoli: isolation and elucidation of structure. In: PNAS. Band 89, Nummer 6, März 1992, S. 2399–2403, PMID 1549603. PMC 48665 (freier Volltext).
- ↑ Y. Zhang, T. W. Kensler u. a.: Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates. In: PNAS. Band 91, Nummer 8, April 1994, S. 3147–3150, PMID 8159717. PMC 43532 (freier Volltext).
- ↑ clinicaltrials.gov: Sulforaphane. abgerufen am 25. September 2012.
- ↑ Klinische Studie (Phase II): Sulforaphane in Treating Patients With Recurrent Prostate Cancer bei Clinicaltrials.gov der NIH
- ↑ Joshi J. Alumkal, Rachel Slottke, Jacob Schwartzman, Ganesh Cherala, Myrna Munar, Julie N. Graff, Tomasz M. Beer, Christopher W. Ryan, Dennis R. Koop, Angela Gibbs, Lina Gao, Jason F. Flamiatos, Erin Tucker, Richard Kleinschmidt, Motomi Mori: A phase II study of sulforaphane-rich broccoli sprout extracts in men with recurrent prostate cancer. In: Investigational new drugs. Band 33, Nr. 2, April 2015, S. 480–489, doi:10.1007/s10637-014-0189-z, PMID 25431127, PMC 4390425 (freier Volltext).
- ↑ G. Kallifatidis, S. Labsch u. a.: Sulforaphane increases drug-mediated cytotoxicity toward cancer stem-like cells of pancreas and prostate. In: Molecular therapy. Band 19, Nummer 1, Januar 2011, S. 188–195, doi:10.1038/mt.2010.216. PMID 20940707. PMC 3017446 (freier Volltext).
- ↑ Annette Tuffs: Preisgekrönte Forschungsergebnisse: Wie Brokkoli-Wirkstoffe die Krebstherapie unterstützen. Universitätsklinikum Heidelberg, Pressemitteilung vom 12. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- ↑ J. K. Moon, J. R. Kim u. a.: Analysis and anti-Helicobacter activity of sulforaphane and related compounds present in broccoli (Brassica oleracea L.) sprouts. In: Journal of agricultural and food chemistry. Band 58, Nummer 11, Juni 2010, S. 6672–6677, doi:10.1021/jf1003573. PMID 20459098.
- ↑ J. W. Fahey, X. Haristoy u. a.: Sulforaphane inhibits extracellular, intracellular, and antibiotic-resistant strains of Helicobacter pylori and prevents benzo[a]pyrene-induced stomach tumors. In: PNAS. Band 99, Nummer 11, Mai 2002, S. 7610–7615, doi:10.1073/pnas.112203099. PMID 12032331. PMC 124299 (freier Volltext).
- ↑ X. Haristoy, K. Angioi-Duprez u. a.: Efficacy of sulforaphane in eradicating Helicobacter pylori in human gastric xenografts implanted in nude mice. In: Antimicrobial agents and chemotherapy. Band 47, Nummer 12, Dezember 2003, S. 3982–3984, PMID 14638516. PMC 296232 (freier Volltext).
- ↑ Akinori Yanaka, Jed W. Fahey, Atsushi Fukumoto, Mari Nakayama, Souta Inoue, Songhua Zhang, Masafumi Tauchi, Hideo Suzuki, Ichinosuke Hyodo, Masayuki Yamamoto: Dietary sulforaphane-rich broccoli sprouts reduce colonization and attenuate gastritis in Helicobacter pylori-infected mice and humans. In: Cancer Prevention Research (Philadelphia, Pa.). Band 2, Nr. 4, April 2009, S. 353–360, doi:10.1158/1940-6207.CAPR-08-0192, PMID 19349290.
- ↑ Young Woon Chang, Jae Young Jang, Yong Ho Kim, Jung-Wook Kim, Jae-Jun Shim: The Effects of Broccoli Sprout Extract Containing Sulforaphane on Lipid Peroxidation and Helicobacter pylori Infection in the Gastric Mucosa. In: Gut and Liver. Band 9, Nr. 4, Juli 2015, S. 486–493, doi:10.5009/gnl14040, PMID 25287166, PMC 4477992 (freier Volltext).
- ↑ Young Woon Chang, Yoo Min Park, Chi Hyuk Oh, Shin Ju Oh, Jun-Hyung Cho, Jung-Wook Kim, Jae-Young Jang: Effects of probiotics or broccoli supplementation on Helicobacter pylori eradication with standard clarithromycin-based triple therapy. In: The Korean Journal of Internal Medicine. Band 35, Nr. 3, Mai 2020, S. 574–581, doi:10.3904/kjim.2019.139, PMID 31830776, PMC 7214376 (freier Volltext).
- ↑ Kaili Du, Yuxin Fan, Dan Li: Sulforaphane ameliorates lipid profile in rodents: an updated systematic review and meta-analysis. In: Scientific Reports. Band 11, Nr. 1, 8. April 2021, S. 7804, doi:10.1038/s41598-021-87367-9, PMID 33833347, PMC 8032686 (freier Volltext).
- ↑ Charlotte N. Armah, Christos Derdemezis, Maria H. Traka, Jack R. Dainty, Joanne F. Doleman, Shikha Saha, Wing Leung, John F. Potter, Julie A. Lovegrove, Richard F. Mithen: Diet rich in high glucoraphanin broccoli reduces plasma LDL cholesterol: Evidence from randomised controlled trials. In: Molecular Nutrition & Food Research. Band 59, Nr. 5, Mai 2015, S. 918–926, doi:10.1002/mnfr.201400863, PMID 25851421, PMC 4692095 (freier Volltext).
- ↑ Masahiro Kikuchi, Yusuke Ushida, Hirokazu Shiozawa, Rumiko Umeda, Kota Tsuruya, Yudai Aoki, Hiroyuki Suganuma, Yasuhiro Nishizaki: Sulforaphane-rich broccoli sprout extract improves hepatic abnormalities in male subjects. In: World Journal of Gastroenterology. Band 21, Nr. 43, 21. November 2015, S. 12457–12467, doi:10.3748/wjg.v21.i43.12457, PMID 26604653, PMC 4649129 (freier Volltext).
- ↑ Andrew W. Zimmerman, Kanwaljit Singh, Susan L. Connors, Hua Liu, Anita A. Panjwani, Li-Ching Lee, Eileen Diggins, Ann Foley, Stepan Melnyk, Indrapal N. Singh, S. Jill James, Richard E. Frye, Jed W. Fahey: Randomized controlled trial of sulforaphane and metabolite discovery in children with Autism Spectrum Disorder. In: Molecular Autism. Band 12, Nr. 1, 25. Mai 2021, S. 38, doi:10.1186/s13229-021-00447-5, PMID 34034808, PMC 8146218 (freier Volltext).
- ↑ Martin Magner, Kateřina Thorová, Veronika Župová, Milan Houška, Ivana Švandová, Pavla Novotná, Jan Tříska, Naděžda Vrchotová, Ivo Soural, Ladislav Jílek: Sulforaphane Treatment in Children with Autism: A Prospective Randomized Double-Blind Study. In: Nutrients. Band 15, Nr. 3, 31. Januar 2023, S. 718, doi:10.3390/nu15030718, PMID 36771424, PMC 9920098 (freier Volltext).
- ↑ Kanwaljit Singh, Susan L. Connors, Eric A. Macklin, Kirby D. Smith, Jed W. Fahey, Paul Talalay, Andrew W. Zimmerman: Sulforaphane treatment of autism spectrum disorder (ASD). In: Proceedings of the National Academy of Sciences of the United States of America. Band 111, Nr. 43, 28. Oktober 2014, S. 15550–15555, doi:10.1073/pnas.1416940111, PMID 25313065, PMC 4217462 (freier Volltext).
- ↑ Sara Momtazmanesh, Zeinab Amirimoghaddam-Yazdi, Hossein Sanjari Moghaddam, Mohammad Reza Mohammadi, Shahin Akhondzadeh: Sulforaphane as an adjunctive treatment for irritability in children with autism spectrum disorder: A randomized, double-blind, placebo-controlled clinical trial. In: Psychiatry and Clinical Neurosciences. Band 74, Nr. 7, Juli 2020, S. 398–405, doi:10.1111/pcn.13016, PMID 32347624.
- ↑ Charity G. Duran, Allison J. Burbank, Katherine H. Mills, Heather R. Duckworth, Maria M. Aleman, Matthew J. Kesic, David B. Peden, Yinghao Pan, Haibo Zhou, Michelle L. Hernandez: A proof-of-concept clinical study examining the NRF2 activator sulforaphane against neutrophilic airway inflammation. In: Respiratory Research. Band 17, Nr. 1, 22. Juli 2016, S. 89, doi:10.1186/s12931-016-0406-8, PMID 27450419, PMC 4957339 (freier Volltext).
- ↑ Robert A. Wise, Janet T. Holbrook, Gerard Criner, Sanjay Sethi, Sobharani Rayapudi, Kuladeep R. Sudini, Elizabeth A. Sugar, Alyce Burke, Rajesh Thimmulappa, Anju Singh, Paul Talalay, Jed W. Fahey, Charles S. Berenson, Michael R. Jacobs, Shyam Biswal, Broccoli Sprout Extract Trial Research Group: Lack of Effect of Oral Sulforaphane Administration on Nrf2 Expression in COPD: A Randomized, Double-Blind, Placebo Controlled Trial. In: PloS One. Band 11, Nr. 11, 2016, S. e0163716, doi:10.1371/journal.pone.0163716, PMID 27832073, PMC 5104323 (freier Volltext).
- ↑ Alvarez-Jubete L, Smyth TJ, Valverde J, Rai DK, Barry-Ryan C: Simultaneous determination of sulphoraphane and sulphoraphane nitrile in Brassica vegetables using ultra-performance liquid chromatography with tandem mass spectrometry., Phytochem Anal. 2014 Mar-Apr;25(2):141-6, PMID 24449540.
- ↑ Ares AM, Valverde S, Bernal JL, Nozal MJ, Bernal J: Development and validation of a LC-MS/MS method to determine sulforaphane in honey., Food Chem. 2015 Aug 15;181:263-9, PMID 25794749.
- ↑ Ares AM, Ayuso I, Bernal JL, Nozal MJ, Bernal J: Trace analysis of sulforaphane in bee pollen and royal jelly by liquid chromatography-tandem mass spectrometry., J Chromatogr B Analyt Technol Biomed Life Sci. 2016 Feb 15;1012-1013:130-6, . PMID 26827280.
- ↑ Mangla B, Alam O, Rub RA, Iqbal M, Singh A, Patel KS, Kohli K: Development and validation of a high throughput bioanalytical UPLC-MS/MS method for simultaneous determination of tamoxifen and sulphoraphane in rat plasma: Application to an oral pharmacokinetic study., J Chromatogr B Analyt Technol Biomed Life Sci. 2020 Sep 1;1152:122260, PMID 32679526.
- ↑ Ann Liza Piberger: Untersuchungen zum Einfluss von Sulforaphan auf die DNA-Einzelstrangbruch- und Nukleotidexzisionsreparatur. 13. Februar 2014, S. 5–9, doi:10.5445/IR/1000043295.
Weblinks
Bearbeiten- sciencedaily.com: UIC Researchers Show How Cancer-Preventing Foods Work, 13. Juli 2005 (engl.)