N-Acetylneuraminsäure
N-Acetylneuraminsäure (abgekürzt NANA von englisch: N-acetylneuraminic acid; veraltet: Lactaminsäure) ist ein Vertreter der Sialinsäuren – acylierte Derivate des Aminozuckers Neuraminsäure. Sie ist die häufigste Sialinsäure und wird daher mitunter selbst als Sialinsäure bezeichnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
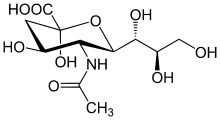
| |||||||||||||||||||
| N-Acetylneuraminsäure, β-Anomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Acetylneuraminsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C11H19NO9 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 309,27 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (50 g·l−1 bei 20 °C),[2] löslich in Methanol, schwer löslich in Ethanol, praktisch unlöslich in Aceton[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung Bearbeiten
N-Acetylneuraminsäure kann aus Milch, Eiern, Schwalbennestern, Submandibular-Mucinen verschiedener Säugetiere und bakteriellen Neuraminsäure-Polymeren (Colominsäuren) isoliert werden.[5]
Die Herstellung gelingt in einem zweistufigen Verfahren aus N-Acetylglucosamin, wobei im ersten Schritt N-Acetylglucosamin basenkatalytisch oder enzymatisch zu N-Acetylmannosamin epimerisiert wird. im zweiten Schritt wird N-Acetylmannosamin mit einem Überschuss Brenztraubensäure unter enzymatischer Katalyse durch eine immobilisierte N-Acetylneuraminsäure-Aldolase zum Endprodukt umgesetzt.[6][7]
Vorkommen Bearbeiten
N-Acetylneuraminsäure ist beim Menschen die einzig vorkommende Sialinsäure, während bei anderen Säugetieren, darunter den Primaten, auch die N-Glycolylneuraminsäure auftritt.[8] Zahlreiche Oligosaccharide, Glykoproteine, Glykolipide und Ganglioside enthalten N-Acetylneuraminsäure als endständigen Zucker in einer α-glycosidischen Bindung.[9]
Eigenschaften Bearbeiten
N-Acetylneuraminsäure ist eine labile Verbindung, die sich bereits beim Stehen in wässriger Lösung zersetzt und sehr Alkali-empfindlich ist.[10]
Mittels Röntgenstrukturanalyse kann gezeigt werden, dass N-Acetylneuraminsäure in der β-Konfiguration kristallisiert. In wässriger Lösung stellt sich durch Mutarotation ein Gleichgewichtsgemisch von 8 % α- und 92 % β-N-Acetylneuraminsäure ein.[9]
Oligosaccharide mit N-Acetylneuraminsäure spielen eine wichtige Rolle bei Protein-Kohlenhydrat-Erkennungsprozessen, die wichtige physiologische Vorgänge, beispielsweise bei Entzündungsprozessen oder Virusinfektionen, steuern.[5]
Einzelnachweise Bearbeiten
- ↑ Eintrag zu ACETYLNEURAMINIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Mai 2020.
- ↑ a b c Eintrag zu N-Acetylneuraminic acid bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 690.
- ↑ a b Datenblatt N-Acetylneuraminic acid bei Sigma-Aldrich, abgerufen am 15. Dezember 2022 (PDF).
- ↑ a b Eintrag zu N-Acetylneuraminsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Dezember 2022.
- ↑ Humphrey, Andrew J and Fremann, Claire and Critchley, Peter and Malykh, Yanina and Schauer, Roland and Bugg, Timothy DH: Biological properties of N-acyl and N-haloacetyl neuraminic acids: processing by enzymes of sialic acid metabolism, and interaction with influenza virus. In: Bioorganic & Medicinal Chemistry. Band 10, Nr. 10, 2002, S. 3175–3185, doi:10.1016/S0968-0896(02)00213-4.
- ↑ Udo Kragl, Daniel Gygax, Oreste Ghisalba, Christian Wandrey: Enzymatische zweistufige Synthese vonN-Acetylneuraminsäure im Enzym-Membranreaktor. In: Angewandte Chemie. Band 103, Nr. 7, 1991, S. 854–855, doi:10.1002/ange.19911030721.
- ↑ Justin L. Sonnenburg, Tasha K. Altheide, Ajit Varki: A uniquely human consequence of domain-specific functional adaptation in a sialic acid-binding receptor. In: Glycobiology. Bd. 14, Nr. 4, April 2004, S. 339–346, PMID 14693915, doi:10.1093/glycob/cwh039.
- ↑ a b Horst Friebolin, Martin Supp, Reinhard Brossmer, Gunda Keilich, Dietmar Ziegler: 1H-NMR-Untersuchungen zur Mutarotation derN-Acetyl-D-neuraminsäure. In: Angewandte Chemie. Band 92, Nr. 3, 1980, S. 200–201, doi:10.1002/ange.19800920315.
- ↑ E. Klenk: Chemie und Biochemie der Neuraminsäure. In: Angewandte Chemie. Band 68, Nr. 10, 1956, S. 349–352, doi:10.1002/ange.19560681003.
