Mosher-Säure
Die Mosher-Säure (abgekürzt als MTPA vom englischen α-Methoxy-α-trifluoromethylphenylacetic acid) ist eine chirale Carbonsäure, die von Harry S. Mosher (1915–2001) eingeführt wurde, um chirale Verbindungen wie Alkohole oder Amine in die entsprechenden Diastereomeren Ester bzw. Amide zu überführen.[3][4][5][6] Beide Enantiomere [die (S)- oder die (R)-Form] der chiralen Mosher-Säure können hierzu eingesetzt werden. Aufgrund seiner sehr viel höheren Reaktivität wird häufig auch das Säurechlorid verwendet.[7]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
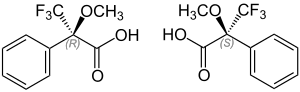
| |||||||||||||||||||
| (R)-Mosher-Säure (links) und (S)-Mosher-Säure (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mosher-Säure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H9F3O3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 234,17 g·mol−1 | ||||||||||||||||||
| Dichte |
1,303 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
95–97 °C (0,05 mmHg)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Anwendung Bearbeiten
Die enantiomerenreine Mosher-Säure wird als chirales Derivatisierungsreagenz von Alkoholen oder Aminen benutzt, um eine chirale Verbindung in ein Diastereomer zu überführen. Schematisch wird die Umsetzung von racemischem Amphetamin mit enantiomerenreinem (S)-Mosher-Säurechlorid gezeigt. Durch das Überführen der (R)-Moshher-Säure in das Säurechlorid ändert sich gemäß den CIP-Regeln die Benennung von (R) zu (S). Die Enantiomere (R)- und (S)-Amphetamin zeigen identische NMR-Spektren, jedoch unterscheiden sich die Diastereomere (RS) und (RR) im NMR voneinander.
Je nach Resonanz sind Shifts von bis zu 47 Hertz möglich.[8]
Mit Hilfe der Diastereomere kann der Enantiomerenüberschuss einer stereospezifischen Reaktion bestimmt oder die absolute Stereochemie eines Produkts ermittelt werden. Zur Bestimmung der absoluten Konfiguration werden die 1H- und 19F-NMR-Spektroskopie benutzt.[9]
Einzelnachweise Bearbeiten
- ↑ a b c Datenblatt (S)-(−)-α-Methoxy-α-(trifluoromethyl)phenylacetic acid, ≥99% bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- ↑ a b c Datenblatt (±)-α-Methoxy-α-trifluoromethylphenylacetic acid, for GC derivatization, LiChropur bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- ↑ J. A. Dale, D. L. Dull, H. S. Mosher: α-Methoxy-α-trifluoromethylphenylacetic acid, a versatile reagent for the determination of enantiomeric composition of alcohols and amines. In: Journal of Organic Chemistry 1969, 34, S. 2543–2549 doi:10.1021/jo01261a013.
- ↑ J. A. Dale, H. S. Mosher: Nuclear magnetic resonance enantiomer regents. Configurational correlations via nuclear magnetic resonance chemical shifts of diastereomeric mandelate, O-methylmandelate, and α-methoxy-α-trifluoromethylphenylacetate (MTPA) esters. In: Journal of the American Chemical Society 1973, 95, S. 512–519 doi:10.1021/ja00783a034.
- ↑ Y. Goldberg, H. Alper: A new and simple synthesis of Mosher's acid. In: Journal of Organic Chemistry 1992, 57, S. 3731–3732 doi:10.1021/jo00039a043.
- ↑ D. L. Dull, H. S. Mosher: Aberrant rotatory dispersion curves of α-hydroxy- and α-methoxy-α-trifluoromethylphenylacetic acids. In: Journal of the American Chemical Society 1967, 89, S. 4230–4230 doi:10.1021/ja00992a053.
- ↑ D. E. Ward, C. K. Rhee: A simple method for the microscale preparation of Mosher's acid chloride. In: Tetrahedron Letters 1991, 32, S. 7165–7166 doi:10.1016/0040-4039(91)80466-J.
- ↑ D. Parker: NMR determination of enantiomeric purity. In: Chem. Rev. 91. Jahrgang, Nr. 7, 1991, S. 1441–1457, doi:10.1021/cr00007a009.
- ↑ Allen, Damian A.; Tomaso, Anthony E., Jr.; Priest, Owen P.; Hindson, David F.; Hurlburt, Jamie L.: Mosher Amides: Determining the Absolute Stereochemistry of Optically-Active Amines. In: J. Chem. Educ. 2008, 85, S. 698. doi:10.1021/ed085p698.
