Molnupiravir
Molnupiravir (Handelsname Lagevrio) ist ein antiviraler Arzneistoff der Pharmaunternehmen Merck Sharp & Dohme (MSD) und Ridgeback Biotherapeutics zur oralen ambulanten Behandlung von milden bis mäßigen Verläufen von COVID-19. Am 24. Februar 2023 sprach sich die Europäische Arzneimittel-Agentur (EMA) dafür aus, die Zulassung von Molnupiravir in der EU zu verweigern. Sie begründete dies damit, dass ein positives Nutzen-Risiko-Verhältnis von Molnupiravir zur Behandlung von COVID-19 nicht ermittelt werden konnte. In Deutschland darf das Mittel nicht mehr abgegeben werden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
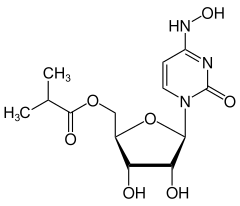
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Molnupiravir[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H19N3O7 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Viruzid | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 329,31 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in DMF und DMSO (jeweils 30 g·l−1 bei 20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Zulassung
BearbeitenEuropäische Union
BearbeitenDas von der Europäischen Arzneimittel-Agentur (EMA) im November 2021 begonnene Zulassungsverfahren[6] mündete am 24. Februar 2023 in der Empfehlung, die Zulassung des Arzneimittel durch die EU-Kommission zu verweigern. Begründet wurde dies damit, dass das Nutzen-Risiko-Verhältnis von Molnupiravir bei der Behandlung von COVID-19 nicht ermittelt werden konnte. Auf Grundlage der verfügbaren Daten sei nicht festgestellt worden, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls verringern oder die Krankheitsdauer oder die Zeit bis zur Genesung verkürzen kann. Die vorläufigen Ergebnisse einer Zwischenauswertung der Zulassungsstudie MOVe-OUT[7][8] konnten gemäß EMA in der gesamten Studienpopulation und nach Auswertung weiterer Daten nicht bestätigt werden. Darüber hinaus sei es nicht möglich gewesen, eine bestimmte Gruppe von Patientinnen und Patienten in der EU zu ermitteln, bei denen ein klinisch relevanter Nutzen von Molnupiravir zu erwarten wäre.[9][10]
In Deutschland darf Lagrevio nach Mitteilung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) mit Wirkung vom gleichen Tag nicht länger in Verkehr gebracht werden, da durch die Beurteilung die rechtliche Grundlage dafür entfallen ist.[10] Auch bereits an den pharmazeutischen Großhandel und Apotheken ausgeliefertes Molnupiravir darf nicht weiter abgegeben werden.[10]
Bis zur neuen Begutachtung vom Februar 2023 hatte die EMA den Einsatz von Molnupiravir bei Notfällen, das heißt bei nicht beatmungspflichtigen COVID-19-Patienten, die ein erhöhtes Risiko hatten, schwer zu erkranken, unterstützt. Ein dazu von der Agentur im November 2021 erstelltes Gutachten konnte zur Unterstützung von Genehmigungen durch nationale Behörden für die frühzeitige Verwendung des Arzneimittels noch vor der Marktzulassung herangezogen werden.[11][12] In Deutschland war vom 3. Januar 2022 bis zum 24. Februar 2023 die Verordnung und Abgabe von Molnupiravir möglich. Aufgrund einer vom Bundesministerium für Gesundheit erlassenen Allgemeinverfügung konnte die Bundesregierung das Mittel vorübergehend auch ohne Marktzulassung im Geltungsbereich des Arzneimittelgesetzes legal beschaffen und in Verkehr bringen.[13] Zuvor hatte schon im Dezember 2021 in Dänemark die Gesundheitsbehörde ebenfalls die Anwendung des nicht marktzugelassenen Mittels genehmigt.[14][15]
Im Juni 2023 zog Merck Sharp & Dohme den Zulassungsantrag zurück.[16]
Großbritannien
BearbeitenAm 4. November 2021 ließ die britische Arzneimittelbehörde MHRA Molnupiravir zur Behandlung von leichtem bis moderaten COVID-19 bei Personen mit Risikofaktoren wie Diabetes mellitus, Adipositas oder Lungen- und Herzkrankheiten sowie bei älteren Personen ab 60 Jahren unter dem Namen Lagevrio bedingt zu.[17][18]
USA, Japan
BearbeitenIn den USA erteilte die FDA am 22. Dezember 2021 eine Notfallzulassung.[19] Zuvor hatte sich das zuständige Prüfgremium der FDA mit einer knappen Mehrheit von 13 zu 10 dafür ausgesprochen. Insbesondere potentielle Nebenwirkungen und mögliche Fluchtmutationen wurden kritisiert.[20] Auch in Japan wurde Molnupiravir im Dezember 2021 für den Notfallgebrauch zugelassen.[21]
China
BearbeitenAufgrund der massiven Corona-Welle in China genehmigten die dort zuständigen Behörden im Dezember 2022 den Einsatz von Molnupiravir des US-amerikanischen Herstellers MSD für die Behandlung von Infizierten mit Risiko für einen schweren Verlauf.[22]
Wirkung
BearbeitenMolnupiravir ist ein Prodrug, ein inaktiver oder wenig aktiver pharmakologischer Stoff, der erst durch Verstoffwechselung (Metabolisierung) im Organismus zu einem aktiven Wirkstoff (Metaboliten) wird. Durch Hydrolyse entsteht das synthetische Nukleosid-Analogon N4-Hydroxycytidin (NHC), das antiviral durch Einführung von Kopierfehlern bei der viralen RNA-Replikation durch virale RNA-Polymerase wirkt. In mehreren Studien wurde diese Wirkung gegen Coronaviren wie SARS-CoV, MERS-CoV und SARS-CoV-2 belegt. Ursprünglich wurde Molnupiravir im Rahmen der Arzneimittelforschung an der Emory University in Atlanta (Georgia, USA) zur Behandlung der Grippe (Influenza) untersucht.[23]
NHC ähnelt dem Nukleosid Cytidin, von dem es sich durch eine zusätzliche OH-Gruppe unterscheidet.[24] NHC existiert in zwei als Tautomere bezeichneten Formen, die sich durch eine Bindungsverschiebung und Protonenwanderung ineinander umwandeln. Dadurch kann NHC sowohl mit Guanosin als auch mit Adenosin Basenpaare bilden und erzeugt so Mutationen im Erbgut. Wirkt NHC wie Cytidin, akzeptiert die Gen-Fehlerkorrektur des Virus dies. Jedoch lassen sich die Bindungen in NHC so verschieben, dass es Uridin imitiert und ein Basenpaar mit Adenosin bildet. Wird Virus-RNA vervielfältigt, wird durch die teilweise „falschen“ Basenpaarungen das Erbgut völlig verändert. Eine fehlerfreie Viren-Vermehrung damit unwahrscheinlicher, es treten zu viele Mutationen auf.
Durch diese Mutationen besteht jedoch auch die Gefahr, dass es zu einer Fluchtmutation (Escape Variante) kommt, gegen die etwa auch die verfügbaren Impfstoffe nicht mehr wirken. „Das wäre katastrophal für die ganze Welt“, mahnte der amerikanische Immunologe James Hildreth, CEO des Meharry Medical College.[20]
Molnupiravir ähnelt strukturell anderen Nukleosidanaloga wie z. B. Remdesivir[23], führt aber anders als Remdesivir nicht zu einem Kettenabbruch bei der DNA-Synthese, der Wirkmechanismus ist wie oben beschrieben ein vollkommen anderer.
Da Molnupiravir bereits in Tierversuchen Schäden an Ungeborenen hervorgerufen hatte,[20] ist sein Einsatz bei Schwangeren und gebärfähigen Frauen nicht empfohlen[25] bzw. kontraindiziert;[26] gebärfähige Frauen müssen eine zuverlässige Verhütungsmethode anwenden.[25]
Klinische Prüfungen
BearbeitenHospitalisierte Patienten
BearbeitenAm 19. Oktober 2020 begann MSD die multinationale Phase-II/III-Studie MOVe-IN zum Vergleich von Molnupiravir gegenüber Placebo bei hospitalisierten COVID-19-Patienten.[27] Die Ergebnisse der Studie zeigten keinen Nutzen von Molnupiravir im Sinne eines Verringerung der Mortalität oder der Zeit bis zur Entlassung aus dem Krankenhaus.[28]
Nicht-hospitalisierte Patienten
BearbeitenDie ebenfalls am 19. Oktober 2020 von MSD begonnene multinationale Phase-II/III-Studie MOVe-OUT verglich Molnupiravir gegenüber Placebo bei nicht-hospitalisierten COVID-19-Patienten.[7] Veröffentlichte Daten einer Zwischenanalyse dieser Studie deuteten zunächst darauf hin, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls um etwa 50 Prozent im Vergleich zu Placebo bei Patienten mit leichter oder mittelschwerer COVID-19 reduziert.[8] Weitere Daten, welche Ende November 2021 veröffentlicht wurden, konnten nur noch eine Risikosenkung um etwa 30 Prozent im Vergleich zur Placebo-Gruppe zeigen.[29] Gemäß EMA konnten die zunächst positiven Ergebnisse der Studie in der gesamten Studienpopulation und nach Auswertung weiterer Daten nicht bestätigt werden. Auf Grundlage der verfügbaren Daten sei nicht festgestellt worden, dass Molnupiravir das Risiko einer Krankenhauseinweisung oder eines Todesfalls verringern oder die Krankheitsdauer oder die Zeit bis zur Genesung verkürzen kann.[9][10]
Synthese
BearbeitenEin möglicher Weg zur Herstellung von Molnupiravir verläuft über eine fünfschrittige Synthese aus Uridin und zeigt eine Ausbeute von nur 17 %. Durch Derivatisierungen und Schutzmaßnahmen verlängert sich zudem die Anzahl an Schritten der Synthese. Außerdem ist Uridin eine sehr teure Substanz.[30]
Deshalb wurde eine alternative Synthese aus Cytidin gefunden, die die Kosten deutlich senken kann. Außerdem kann die Synthese auf einen zweistufigen Prozess reduziert werden, der aus einer Veresterung und einer Transaminierung besteht. Mit 75 % Ausbeute wird Molnupiravir erhalten, wenn zuerst eine Veresterung durchgeführt wird. Alternativ kann erst eine Hydroxiaminierung und dann eine Veresterung durchgeführt werden. Dabei wird eine Ausbeute von nur 37 % über beide Schritte erhalten. Für die Veresterung wird dabei Isobuttersäureoximester sowie Novoenzym 435 als Katalysator und 1,4-Dioxan als Lösungsmittel verwendet. Für die Transaminierung wird NH2OH-H2SO4 in Isopropanol verwendet, wodurch eine Dihydroxiaminierung vollständig vermieden werden kann.[30]
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 85, World Health Organisation (WHO), 6. April 2021.
- ↑ EIDD steht für „Emory Institute for Drug Development“.
- ↑ a b c AstaTech: SDS AT13078, abgerufen am 21. April 2021.
- ↑ a b Rachel Bade, Jameson R. Bothe, Eric Sirota, Andrew P. J. Brunskill, Justin A. Newman, Yongqian Zhang, Melissa Tan, Michelle Zheng, Gilmar Brito, Marc Poirier, Patrick S. Fier, Yingju Xu, Michael D. Ward, Kevin Stone, Ivan H. Lee, Andrew J. Gmitter, Frank Bernardoni, Michael A. Zompa, Hanlin Luo, Sanjaykumar Patel, Tina Masiuk, Jeff Mora, Tong Ni, Grace A. Okoh, James Tarabokija, Jiaying Liu, Michael B. Lowinger, Tariq Mahmood: Polymorphs, Particle Size, and a Pandemic: Development of a Scalable Crystallization Process for Molnupiravir, an Antiviral for the Treatment of COVID-19 in Org. Process Res. Dev. 27 (2023) 2100–2110, doi:10.1021/acs.oprd.3c00268, Supporting Information pdf.
- ↑ Eidd-2801 (cas 2349386-89-4). In: caymanchem.com. Abgerufen am 21. April 2021 (englisch).
- ↑ CEMA receives application for marketing authorisation for Lagevrio (molnupiravir) for treating patients with COVID 19. In: EMA. 23. November 2021, abgerufen am 3. Januar 2022 (englisch).
- ↑ a b Klinische Studie (Phase 2/3): Efficacy and Safety of Molnupiravir (MK-4482) in Non-Hospitalized Adult Participants With COVID-19 (MK-4482-002) bei Clinicaltrials.gov der NIH
- ↑ a b Jayk Bernal A, Gomes da Silva MM, et al.: Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. In: N Engl J Med. Band 386, Nr. 6, 10. Februar 2022, S. 509–520, doi:10.1056/NEJMoa2116044, PMID 34914868, PMC 8693688 (freier Volltext).
- ↑ a b Refusal of the marketing authorisation for Lagevrio (molnupiravir). Europäische Arzneimittel-Agentur (EMA), 24. Februar 2023, abgerufen am 27. Februar 2023.
- ↑ a b c d Ablehnung des Zulassungsantrags von Lagevrio (Molnupiravir) und Beendigung des Inverkehrbringens in Deutschland. Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), 24. Februar 2023, abgerufen am 27. Februar 2023.
- ↑ EMA unterstützt Einsatz von Corona-Pille für Notfälle. In: ntv.de. 19. November 2021, abgerufen am 20. November 2021.
- ↑ Europäische Arzneimittel-Agentur EMA: EMA issues advice on use of Lagevrio (molnupiravir) for the treatment of COVID-19. 19. November 2021, abgerufen am 20. November 2021 (englisch). Anwendungshinweise/weitere Informationen zum Medikament hat die EMA bereitgestellt unter Europäische Arzneimittel-Agentur EMA: Lagevrio (also known as molnupiravir or MK 4482) – COVID-19 – Article-5(3) procedure: Conditions of use, conditions for distribution and patients targeted and conditions for safety monitoring. (PDF) 19. November 2021, abgerufen am 20. November 2021.
- ↑ Verordnung von Molnupiravir trotz fehlender Zulassung. In: www.gelbe-liste.de. 3. Januar 2022, abgerufen am 3. Januar 2022.
- ↑ Denmark allows unapproved pill for at-risk Covid-19 patients in line with EMA advice, medwatch.com, 16. Dezember 2021.
- ↑ Sundhedsstyrelsens anmeldelse: Lagevrio (molnupiravir) til covid-19, Dänische Gesundheitsbehörde, 16. Dezember 2021.
- ↑ https://www.ema.europa.eu/en/medicines/human/withdrawn-applications/lagevrio, abgerufen am 4. Juli 2023.
- ↑ First oral antiviral for COVID-19, Lagevrio (molnupiravir), approved by MHRA. In: gov.uk. 4. November 2021, abgerufen am 4. November 2021.
- ↑ Großbritannien lässt Pille zur Covid-19-Behandlung zu. In: spiegel.de. 4. November 2021, abgerufen am 4. November 2021.
- ↑ Coronavirus (COVID-19) Update: FDA Authorizes Additional Oral Antiviral for Treatment of COVID-19 in Certain Adults, FDA, 23. Dezember 2021.
- ↑ a b c Spencer Kimball: FDA authorizes Pfizer's Covid treatment pill, the first oral antiviral drug cleared during the pandemic. 22. Dezember 2021, abgerufen am 23. Dezember 2021 (englisch).
- ↑ Merck and Ridgeback’s Molnupiravir, an Investigational Oral Antiviral COVID-19 Treatment, Receives Special Approval for Emergency in Japan, Pressemitteilung MSD, 24. Dezember 2021.
- ↑ Notfallzulassung für Molnupiravir in China, Pharmazeutische Zeitung, 30. Dezember 2022.
- ↑ a b A. Rößler: SARS-CoV-2-Ansteckungen im Tierversuch verhindert. In: www.pharmazeutische-zeitung.de. 4. Dezember 2020.
- ↑ Florian Kabinger et al.: Mechanism of molnupiravir-induced SARS-CoV-2 mutagenesis. In: Nature Structural & Molecular Biology. Band 28, Nr. 9, September 2021, S. 740–746, doi:10.1038/s41594-021-00651-0.
- ↑ a b Lagevrio – Art. 5(3) Informationen für Angehörige der medizinischen Fachkreise, BfArM, 23. Dezember 2021.
- ↑ Hinweise für den Anwendenden – Lagevrio 200 mg Hartkapseln, BfArM, 17. Dezember 2021.
- ↑ Klinische Studie (Phase 2/3): Efficacy and Safety of Molnupiravir (MK-4482) in Hospitalized Adult Participants With COVID-19 (MK-4482-001) bei Clinicaltrials.gov der NIH
- ↑ José R. Arribas, Sanjay Bhagani, Suzana M. Lobo, et al.: Randomized Trial of Molnupiravir or Placebo in Patients Hospitalized with Covid-19. In: NEJM Evidence. Band 1, Nr. 2, 16. Dezember 2021, doi:10.1056/EVIDoa2100044.
- ↑ Merck and Ridgeback Biotherapeutics Provide Update on Results from MOVe-OUT Study of Molnupiravir, an Investigational Oral Antiviral Medicine, in At Risk Adults With Mild-to-Moderate COVID-19. Abgerufen am 26. November 2021 (amerikanisches Englisch).
- ↑ a b c N. Vasudevan, Grace P. Ahlqvist, Catherine P. McGeough, Dinesh J. Paymode, Flavio S. P. Cardoso, Tobias Lucas, Jule-Phillip Dietz, Till Opatz, Timothy F. Jamison, Frank B. Gupton, David R. Snead: A concise route to MK-4482 (EIDD-2801) from cytidine. In: Chemical Communications. Band 56, Nr. 87, 2020, S. 13363–13364, doi:10.1039/D0CC05944G.