Kupferphthalocyanin
Kupferphthalocyanin ist eine chemische Komplex-Verbindung von Kupfer und Phthalocyanin. Es ist ein blauer Feststoff, der in Form eines Pulvers oder metallisch glänzender Nadeln vorliegt. Kupferphthalocyanin ist das wichtigste blaue Pigment. Es wird vielseitig für Lacke, Kunststoffe und Druckfarben verwendet. Kupferphthalocyaninpigmente besitzen eine hohe Temperaturbeständigkeit und ausgezeichnete Echtheiten gegen Licht, Wetter und chemische Einflüsse.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
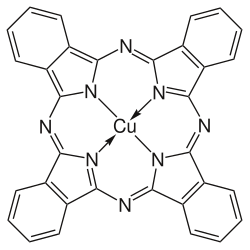
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupferphthalocyanin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C32H16CuN8 | ||||||||||||||||||
| Kurzbeschreibung |
blauer, geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 576,07 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,61 g·cm−3 [3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Geschichte
Bearbeiten1927 wurden von Henri de Diesbach und E. von der Weid in der Zeitschrift Helvetica Chimica Acta über die Synthese des Kupferphthalocyanins und dessen Eigenschaften und farbliche Brillanz berichtet, ohne jedoch die wirtschaftliche Bedeutung zu erkennen. 1934 produzierte ICI in Trafford Park (Manchester) das erste Kupferphthalocyanin (CuPc) und brachte es auf den Markt, in Deutschland bekannt unter dem Namen Monastralechtblau B. 1936 kam Bayer mit einem eigenen Herstellungsprozess von CuPc unter dem Handelsnamen Heliogenblau B dazu. Die bisher verwendeten anorganischen Pigmente Ultramarin und Preußisch Blau wurden in den folgenden Jahren weitgehend verdrängt.
Gewinnung und Darstellung
BearbeitenKupferphthalocyanin wird technisch durch Reaktion von Phthalsäureanhydrid mit Kupfer(I)-chlorid und Harnstoff sowie Ammoniumheptamolybdat als Katalysator unter Erhitzen hergestellt. Ein Alternativverfahren ist die thermische Reaktion von Phthalsäuredinitril mit metallischem Kupfer oder Kupfersalzen bei Anwesenheit von Ammoniak oder Harnstoff.
1993 wurden bereits mehr als 10.000 Tonnen pro Jahr produziert.[3] Damit zählt es zu den chemischen Substanzen, die in großen Mengen hergestellt werden („High Production Volume Chemical“, HPVC) und für die von der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) eine Datensammlung zu möglichen Gefahren („Screening Information Dataset“, SIDS) angefertigt wurde.[3]
Eigenschaften
BearbeitenKupferphthalocyanin existiert in elf Modifikationen,[5] von denen drei von wirtschaftlicher Bedeutung sind. Es sind dies die thermisch weniger stabile rotstichige α-Form (C.I. Pigment Blue 15:0, 15:1 und 15:2), die stabile grünstichige β-Form (C.I. Pigment Blue 15:3 und 15:4), sowie die stark rotstichige ε-Form (C.I. Pigment Blue 15:6).
Die Europäische Union plante 2020 wegen gesundheitlicher Risiken ein Verbot der Pigmente „Kupferphthalocyanin|Blau 15:3“ und „Grün 7“ für Tätowierfarben, da deren Dokumentation nicht den Anforderungen der EU-Chemikalienverordnung REACH genüge.[6] Schließlich wurde aufgrund noch fehlender sicherer Alternativen eine Übergangsfrist von 24 Monaten bis zum 4. Januar 2023 gewährt.[7]
Verwendung
BearbeitenDer überwiegende Anteil von Kupferphthalocyanin wird als hochechtes Pigment verwendet. Es ist das in der Menge häufigste Pigment für den blauen Farbbereich in Lacken und Anstrichfarben, Kunststoffen und Druckfarben. So sind die blauen Recyclingtonnen für Papierabfälle mit diesem Pigment eingefärbt. Verschiedene, besonders qualitätsüberwachte Marken sind als Farbmittel für Konsumprodukte zugelassen, für den Einsatz in Pflegemitteln, Stempelfarben, Kosmetikartikel wie Zahncreme[8] und für Lebensmittel-Verpackungsmitteln.
Im Bereich Farben und Lacke sind die α- und die β-Modifikation die standardmäßig verwendeten Pigmente für den Bereich Blau. Die ε-Modifikation hat einen grünlicheren Ton, wirkt aber wegen der instabileren Pigmenteigenschaften in Lacken rötlicher. Dies stellt aufgrund dieses Farbwechsels eine Spezialität für Automobil-Metalliclacke dar.[9]
In Druckfarben ist die β-Modifikation von Kupferphthalocyanin (Pigment Blau 15:3) der Cyan-Standard für den Dreifarbendruck und Vierfarbendruck.
Kupferphthalocyanin ist eines der am häufigsten verwendeten Donatormaterialen in organischen Solarzellen, wo es durch seine blaue Farbe auch für einen Großteil der Absorption verantwortlich ist.[10] In der Tat basierte bereits die erste organische Solarzelle auf Kupferphthalocyanin.[11]
Das Zentralatom Kupfer stabilisiert die Verbindung gegen Reduktion, sodass das Cu-Dihydrophthalocyanin nur mit starkem Reduktionsmittel erhalten wird und unverzüglich wieder zum blauen Pigment oxidiert. Demgegenüber bildet Cobaltphthalocyanin eine stabile, farblose Dihydro-Verbindung, die gegen mäßige Oxidation stabil ist. Dieses wird in Dokumentenpapieren als Sicherheitsmerkmal gegen oxidative Verfälschung eingesetzt. Die schwachgefärbte Dihydro-Nickelverbindung wird bereits durch Luftsauerstoff zu einem grünstichigen Blaupigment oxidiert – entsprechend der Stellung im PSE der achten Nebengruppe: Cobalt – Nickel – Kupfer.
Ein Teil von Rohkupferphthalocyanin wird chloriert und als Phthalocyaningrün verwendet (C.I. Pigment Grün 7). Es ist das am häufigsten eingesetzte Pigment für den grünen Farbbereich. Da es komplett chloriert ist, ist die Bezeichnung Polychlorkupferphthalocyanin ebenfalls üblich. Zur Verwendung als blauer Dispersionsfarbstoff mit rötlichem Farbstich und guten Echtheiten werden Mengen des Pigments sulfoniert oder sulfochloriert und erhalten dadurch die notwendigen Eigenschaften für den Einsatz in der Textilindustrie. Eine bestimmte Menge dieses Produkts wird auf Grund der Löslichkeit als Sicherheitsstoff gegen Verfälschung mit organischen Lösungsmitteln verwendet.
Das reversibel wasserlösliche CuPc-Derivat Alcianblau wird in der Biochemie zum Einfärben und Markieren verwendet.
Weblinks
Bearbeiten- Heliogenblau, Phthalocyaninblau PB 15, Kremer-Pigmente.de
Einzelnachweise
Bearbeiten- ↑ Eintrag zu CI 74160 in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. März 2020.
- ↑ a b c d Eintrag zu Kupferphthalocyanin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Juni 2023. (JavaScript erforderlich)
- ↑ a b c d OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Copper, phthalocyaninato-, abgerufen am 3. Oktober 2014.
- ↑ Eintrag zu Pigment Blue 15 in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ P. Erk, H. Hengelsberg: Phthalocyanine Dyes and Pigments in Porphyrin Handbook 19 (2003), S. 105–149, ISBN 0-12-393229-7.
- ↑ EU-Kommission prüft Verbot – Mögliches Aus für die Tätowierfarben Blau 15 und Grün 7. Abgerufen am 13. Mai 2021.
- ↑ Verordnung (EU) 2020/2081 der Kommission vom 14. Dezember 2020 zur Änderung des Anhangs XVII der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) betreffend Stoffe in Tätowierfarben oder Permanent-Make-up
- ↑ CI-74160 auf Cosmeticanalysis.com. Abgerufen am 11. April 2018.
- ↑ W. Herbst, K. Hunger, Industrielle Organische Pigmente, 3. Auflage, Wiley-VCH, Weinheim 2004.
- ↑ Yu-Sheng Hsiao, Wha-Tzong Whang, Shich-Chang Suen, Jau-Ye Shiu und Chih-Ping Chen: Morphological control of CuPc and its application in organic solar cells. In: Nanotechnology 2008, 19, 415603 doi:10.1088/0957-4484/19/41/415603
- ↑ C.W. Tang: Twolayer organic photovoltaic cell. In: Appl. Phys. Lett. Band 48, Nr. 18, 1985, S. 183–185, doi:10.1063/1.96937.