Kaliumperoxomonosulfat
Kaliumperoxomonosulfat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Sulfate und das Kaliumsalz der Peroxomonoschwefelsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
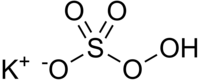
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumperoxomonosulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | KHSO5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
2,18 g·cm−3 (Monohydrat)[2] | ||||||||||||||||||
| Schmelzpunkt |
109 °C[3] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Gewinnung und Darstellung
BearbeitenKaliumperoxomonosulfat kann durch Reaktion von Kaliumcarbonat oder Kaliumhydroxid mit Peroxomonoschwefelsäure gewonnen werden.[3]
Kaliumperoxomonosulfat-Monohydrat kann aus dem Tripelsalz oder durch Hydrolyse von Kaliumperoxodisulfat gewonnen werden.[5][2] Das Anhydrat kann daraus durch Trocknung im Vakuum gewonnen werden.[6]
Eigenschaften
BearbeitenVon Kaliumperoxomonosulfat existiert auch ein Monohydrat mit monokliner Kristallstruktur und der Raumgruppe C2/c (Raumgruppen-Nr. 15).[3][2]
Verwendung
BearbeitenKaliumperoxomonosulfat wird als Oxidationsmittel bei der chemischen Synthese,[7] als Desinfektionsmittel in Schwimmbädern, der Medizin und in der Wasseraufbereitung verwendet.[8]
Tripelsalz
Bearbeiten| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| Name |
Tripelsalz | |||||||
| CAS-Nummer |
| |||||||
| EG-Nummer |
274-778-7 | |||||||
| ECHA-InfoCard | ||||||||
| ||||||||
Als Tripelsalz wird eine Mischung aus Kaliumperoxomonosulfat, Kaliumhydrogensulfat und Kaliumsulfat (2KHSO5·KHSO4·K2SO4) bezeichnet.
Hierbei handelt es sich um einen kristallinen weißen geruchlosen Feststoff, der leicht löslich in Wasser (256 g·l−1 bei 20 °C) ist. Er zersetzt sich bei Erhitzung über ca. 90 °C. Seine wässrige Lösung reagiert stark sauer. Die Dichte liegt bei 1,1–1,2 g·cm−3, der Schmelzpunkt bei 90 °C (Zersetzung).[9]
Das Tripelsalz wird zur Halogenierung von α,β-ungesättigten Carbonylverbindungen und zur katalytischen Erzeugung von hypervalenten Iodverbindungen für Alkoholoxidation und für Synthese von Oxaziridinen und Dioxiranen wie Dimethyldioxiran verwendet.[10][11] Dies ist die Basis der Shi-Epoxidierung.[12]
Weiterhin wird das Tripelsalz als Bleich- und Reinigungszusatz für Textilien und Zahnprothesen sowie als Ätzmittel zur Oberflächenbehandlung verwendet.[13] Es dient auch zur Schrumpffestausrüstung der Wolle.[14]
Handelsnamen des Tripelsalzes sind „Oxone“ oder „Caroat“.
Einzelnachweise
Bearbeiten- ↑ a b Andreas Agster: Färberei und textilchemische Untersuchungen. Springer Berlin Heidelberg, S. 131 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c E. O. Schlemper, R. C. Thompson, C. K. Fair, F. K. Ross, E. H. Appelman, L. J. Basile: Structure, deformation density and atomic charges in potassium hydrogenperoxomonosulfate monohydrate, KHSO5·H2O. In: Acta Crystallographica Section C: Crystal Structure Communications. Band 40, Nr. 11, 1984, S. 1781–1785, doi:10.1107/S0108270184009537 (iucr.org).
- ↑ a b c d Jane E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992, ISBN 978-0-412-30120-9, S. 3535 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Travis, B., Ciaramitaro, B., Borhan, B. (2002): Preparation of Purified KHSO5·H2O and nBu4NHSO5 from Oxone by Simple and Efficient Methods. Eur. J. Org. Chem., 2002: 3429–3434, doi:10.1002/1099-0690(200210)2002:20<3429::AID-EJOC3429>3.0.CO;2-D
- ↑ Evan H. Appelman, Louis J. Basile, Hyunyong Kim, John R. Ferraro: Molecular vibrational spectra of potassium peroxymonosulfate, KHSO5 and KHSO5 · H2O, and of the aqueous peroxymonosulfate ion. In: Spectrochimica Acta Part A: Molecular Spectroscopy. Band 41, Nr. 11, 1985, S. 1295–1300, doi:10.1016/0584-8539(85)80237-3.
- ↑ Albert Matlack: Introduction to Green Chemistry, Second Edition. CRC Press, 2010, ISBN 978-1-4398-8211-5, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Johann Mutschmann, Fritz Stimmelmayr: Taschenbuch der Wasserversorgung. Springer-Verlag, 2013, ISBN 978-3-663-12397-2, S. 191 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Eintrag zu Pentakaliumbis(peroxymonosulfat)bis(sulfat) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ F.von Rheinbaben, M.H. Wolff: Handbuch der viruswirksamen Desinfektion. Springer-Verlag, 2013, ISBN 978-3-642-56394-2, S. 127 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt Oxone, monopersulfate bei Alfa Aesar, abgerufen am 15. Juli 2016 (Seite nicht mehr abrufbar).
- ↑ Michael Frohn, Yian Shi: Chiral Ketone-Catalyzed Asymmetric Epoxidation of Olefins. In: Synthesis. 2000, S. 1979, doi:10.1055/s-2000-8715.
- ↑ HELM AG: Kaliumperoxomonosulfat ( vom 15. August 2016 im Internet Archive), abgerufen: 15. Juli 2016.
- ↑ Eintrag zu Kaliumhydrogenperoxomonosulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. April 2017.