Diacetoxyiodbenzol
Diacetoxyiodbenzol (Akronyme: DAIB, DIB, BAIB, PIDA; veraltet: Essigsaures Iodosobenzol) ist eine organische chemische Verbindung, die zuerst 1892 von Conrad Willgerodt synthetisiert wurde.[4] Es ist ein versatiles Oxidationsmittel, welches oft in Kombination mit elementarem Iod verwendet wird; z. B. in der Suaréz-Modifikation der Hofmann-Löffler-Freytag-Reaktion.[5][6]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
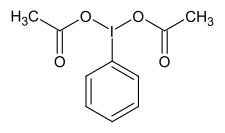
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diacetoxyiodbenzol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H11IO4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 321,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung Bearbeiten
Diacetoxyiodbenzol kann aus Iodosobenzol gewonnen werden, indem dieses mit Essigsäure unter Wasserabspaltung umgesetzt wird.[1] Eine weitere Herstellvariante ist die Oxidation von Iodbenzol mit Peressigsäure, Natriumperborat, Natriumperiodat oder Chrom(VI)-oxid.[3]
Eigenschaften Bearbeiten
Physikalische Eigenschaften Bearbeiten
Diacetoxyiodbenzol kristallisiert in flachen, farblosen Prismen.[1]
Chemische Eigenschaften Bearbeiten
Diacetoxyiodbenzol zeigt oberhalb der Schmelzpunktes eine exotherme Zersetzung.[7] Als Zersetzungsprodukte wurden Methyliodid, Iodbenzol, Phenylacetat, Essigsäure und Kohlendioxid gefunden.[8] Die Verbindung ist gegenüber Wasser nicht beständig.[1] Es zeigt bei Reaktionen ähnliche Eigenschaften wie Bleitetraacetat, ist aber allgemein effektiver als jenes.[9]
Verwendung Bearbeiten
Die Verbindung kann als Photoinitiator für die kationische und radikalische Polymerisation von Methacrylaten, Styrol und Isobutylvinylether eingesetzt werden.[10]
Einzelnachweise Bearbeiten
- ↑ a b c d e f g h C. Willgerodt: Die organischen Verbindungen mit mehrwertigem Iod. In: J. Schmidt (Hrsg.): Chemie in Einzeldarstellungen. Band 7. Verlag von Ferdinand Enke, Stuttgart 1914, S. 30–33 (archive.org).
- ↑ a b c d Datenblatt (Diacetoxyiod)-benzol bei Sigma-Aldrich, abgerufen am 13. Mai 2022 (PDF).
- ↑ a b c d e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2024, John Wiley and Sons, Inc., Eintrag für (Diacetoxyiodo)benzene, abgerufen am 15. Februar 2024.
- ↑ C. Willgerodt: Zur Kenntniss aromatischer Jodidchloride, des Jodoso‐ und Jodobenzols. In: Berichte der deutschen chemischen Gesellschaft. Band 25, Nr. 2, Juli 1892, S. 3494–3502, doi:10.1002/cber.189202502221.
- ↑ R. Hernández, A. Rivera, J. A. Salazar, E. Suárez: Nitroamine radicals as intermediates in the functionalization of non-activated carbon atoms. In: Journal of the Chemical Society, Chemical Communications. Band 20, 1980, S. 958–959, doi:10.1039/C39800000958.
- ↑ C. G. Francisco, A. J. Herrera, E. Suárez: Intramolecular hydrogen abstraction reaction promoted by N-radicals in carbohydrates. Synthesis of chiral 7-oxa-2-azabicyclo[2.2.1]heptane and 8-oxa-6-azabicyclo[3.2.1]octane ring systems. In: The Journal of Organic Chemistry. Band 68, Nr. 3, 2003, S. 1012–1017, doi:10.1021/jo026314h.
- ↑ Verma, V.; Singh, K.; Kumar, A.; Kumar, D.: Thermal studies of hypervalent iodine reagents in J. Therm. Anal. Calorim. 14 (2013) 339–344, doi:10.1007/s10973-012-2894-1.
- ↑ Leffler, J.E.; Story, L.J.: The Decomposition of Aryl Iodine Diacetates in J. Amer. Chem. Soc. 89 (1967) 2333–2338, doi:10.1021/ja00986a016.
- ↑ J. I. Concepción, C. G. Francisco, R. Hernández, J. A. Salazar, E. Suárez: Intramolecular hydrogen abstraction. Iodosobenzene diacetate, an efficient and convenient reagent for alkoxy radical generation. In: Tetrahedron Letters. Band 25, Nr. 18, 1984, S. 1953–1956, doi:10.1016/S0040-4039(01)90085-1.
- ↑ G. Georgiev, E. Kamenska, L. Christov, I. Sideridou-Karayannidou, G. Karayannidis, A. Varvoglis: (Diacetoxyiodo)benzene and [bis(trifluoro-acetoxy)iodo]benzene as photoinitiators for radical and cationic polymerization in Eur. Polym. J.28 (1992) 207–211, doi:10.1016/0014-3057(92)90177-4.