Acyclische Dienmetathese-Polymerisation
Die acyclische Dienmetathese-Polymerisation (englisch acyclic diene metathesis), auch ADMET-Polymerisation genannt, ist eine Variante der Alkenmetathese, bei der Diolefine mit endständigen Doppelbindungen (α,ω-Diene) in einer als Stufenwachstumsreaktion ablaufenden Gleichgewichtsreaktion in Gegenwart von Übergangsmetall-Carbenkomplexen als Katalysatoren zu linearen Polymeren mit olefinischen Doppelbindungen im Polymerrückgrat unter Abspaltung von Ethen reagieren.
Geschichte
BearbeitenDie acyclische Dienmetathese-Polymerisation wurde 1991 von Kenneth B. Wagener erstmals anhand höhermolekularer Polymerer am Beispiel der Polymerisation von 1,9-Decadien zu Polyoctenamer (hier Polyoctenylene genannt) und 1,5-Hexadien zu 1,4-Polybutadien mit dem Katalysator Wolfram(VI)-chlorid WCl6 und dem Cokatalysator Ethylaluminiumdichlorid EtAlCl2 beschrieben.[1]
Die quantitative Hydrierung der olefinischen Doppelbindungen im Polymerrückgrat liefert eine gesättigte Polymerkette, die der eines völlig linearen Polyethylens gleicht.[2] Das von K.B. Wagener als Polyoctenylene bezeichnete Polymer ist dem durch ringöffnende Metathesepolymerisation (engl. ring opening metathesis polymerization, ROMP) aus Cycloocten erhältlichen Polyoctenamer ähnlich,
einem auch als trans-Polyoctenamer-Kautschuk (engl. trans-polyoctylene rubber, TOR) bekannten Gummiadditiv (Vestenamer 8012® der Fa. Evonik), das allerdings bis zu 25 Gew.-% an Macrocyclen mit Molmassen bis 100,000 g·mol−1 aufweisen kann.[3]
Frühere Beobachtungen,[4] dass das Katalysatorsystem WCl6/EtAlCl2/EtOH sowohl eine ROMP als auch eine Olefindisproportionierung begünstigen kann, legten den Schluss nahe, dass beiden chemischen Umwandlungen die gleiche Reaktion zugrunde liegen sollte.
Der bereits 1971 von Yves Chauvin vorgeschlagene Reaktionsmechanismus für die Olefinmetathese,[5] über Metallacyclobutane erwies sich als wegweisend für das Verständnis der Metathesereaktionen vom ROMP- und ADMET-Typ. Die in den späten 1980er Jahren beginnenden Arbeiten im Arbeitskreis von K.B. Wagener lieferten bei der anfänglich „α,ω-Dienpolykondensation“ genannten acyclische Dienmetathese-Polymerisation mit WCl6/EtAlCl2-Katalysatoren noch keine brauchbaren Polymeren.[6]
Erst mit den zur gleichen Zeit von Richard R. Schrock gefundenen neutralen und Lewis-Säure-freien Wolfram-[7] und Molybdän-Komplexen[8] gelang die zuverlässige Unterdrückung der Vinylpolymerisation zugunsten der Olefinmetathese und damit die Herstellung von höhermolekularen Polymeren.[1]
Wolframcarbenkomplexe katalysieren die Olefinmetathese deutlich schneller und die gebildeten Wolframcyclobutane sind stabiler als die entsprechenden Molybdänverbindungen, aber weniger tolerant gegenüber funktionellen Gruppen im α,ω-Dien. Die Molybdänkatalysatoren wiederum sind einfacher zu handhaben und ermöglichen die acyclische Dienmetathese-Polymerisation von u. a. Estern, Carbonaten, Ethern, aromatischen Aminen und Siloxanen.[9]
1992 wurden aus dem Arbeitskreis von R.H. Grubbs die ersten Olefinmetathese-Katalysatoren auf Basis von Ruthenium-Verbindungen (Grubbs-Katalysatoren) beschrieben,[10] die wesentlich stabiler in Luft und unempfindlicher gegen funktionelle Gruppen in den Dienen und Lösungsmitteln waren. Die Tricyclohexylphosphin-Komplexe sind deutlich stabiler als die Triphenylphosphinanaloga. Der prominenteste Vertreter der sog. 1. Generation der Grubbs-Katalysatoren für die acyclische Dienmetathese-Polymerisation ist Benzylidenbis(tricyclohexylphosphin)dichlororuthenium[11]
Grubbs-Katalysatoren der 1. Generation zeichnen sich durch eine sehr niedrige (< 5 %) Isomerisierungsrate bei der acyclische Dienmetathese-Polymerisation aus.[12]
Eine Weiterentwicklung mit größerer Stabilität gegenüber Sauerstoff und Wasser – und damit auch einfacherer Handhabung – stellen die Grubbs-Katalysatoren der sog. 2. Generation mit einem imidazolbasierten Liganden dar, die darüber hinaus höhere Aktivität bei der Olefinmetathese besitzen, die denen der Schrock‘schen Molybdänkomplexe nahekommt.[13] Grubbs-Katalysatoren der 2. Generation neigen sehr viel stärker zur Isomerisierung (bis zu 90 %), die aber durch Zugabe von [1,4-Benzochinon] bis auf kleiner 10 % zurückgedrängt werden kann.[14]
Durch den Ersatz des unsubstituierten Benzyliden-Liganden durch einen Benzyliden-Liganden mit einer chelatisierenden ortho-ständigen Isopropyloxy-Gruppe erhält man die sog. Hoveyda-Grubbs-Katalysatoren, bei denen einer (1. Generation) oder beide (2. Generation) der Tricyclohexylphosphin-Liganden ersetzt sein können, so dass auch phosphinfreie Komplexe zugänglich sind.[15] Die erhaltenen chiralen Rutheniumkomplexe zeichnen sich durch Stabilität an der Luft und hohe Aktivität für stereoselektive Umsetzungen (bis > 98 %) aus, auch bei Reaktionen an der Luft, mit ungereinigten Lösungsmitteln und mit Ausgangsverbindungen, die sonst nur mit molybdänbasierten Katalysatoren polymerisieren.
Die Hoveyda-Grubbs-Katalysatoren sind aus den entsprechenden Grubbs-Katalysatoren in einstufiger Reaktion leicht zugänglich und robuster als diese. Die Katalysatoren sind wegen ihrer hohen Stabilität chromatographierbar und wiedergewinnbar, allerdings auch teurer und mit einer oft längeren Induktionsphase etwas umständlicher in der Handhabung.[16] Weitere Modifikationen eignen sich auch zu acyclische Dienmetathese-Polymerisation, wobei sperrige und elektronenreichere Liganden einen höheren Polymerisationsgrad und sehr kurze Initialphasen bewirken.[17]
Als Grubbs-Katalysatoren der 3. Generation werden neuere Varianten bezeichnet mit z. B. 3-Brompyridin-Liganden mit drastisch verkürzten Induktionsphasen[18] oder mit weniger raumerfüllenden Liganden (z. B. Tolyl- statt Mesityleinheiten), die allylische Olefine effizienter verknüpfen.[19]
Mit den modernen Übergangsmetallkatalysatoren können inzwischen viele funktionelle α,ω-Diene, z. B. auch aus nachwachsenden Rohstoffen,[20] wie z. B. 10-Undecen-1-ol, unter milden Bedingungen mittels acyclische Dienmetathese-Polymerisation zu brauchbaren Polymeren umgesetzt werden.
Für die „Entwicklung der Metathese-Reaktionen in der organischen Synthese“ erhielten Yves Chauvin, Robert H. Grubbs und Richard R. Schrock im Jahr 2005 den Nobelpreis für Chemie.[21]
Charakteristika der acyclische Dienmetathese-Polymerisation
BearbeitenBei der Olefinmetathese kommt es zur statistischen Neuverteilung funktioneller Gruppen durch den Austausch von Alkylidengruppen zwischen zwei verschiedenen Olefinmolkülen.
Dabei reagieren wegen ihrer geringeren sterischen Hinderung einfach substituierte endständige (terminale) Doppelbindungen wesentlich einfacher als mehrfach substituierte.
Schrock-Katalysatoren können auch sterisch anspruchsvollere Diene polymerisieren und sind generell aktiver als Grubbs-Katalysatoren, die ihrerseits viele unterschiedliche funktionelle Gruppen tolerieren. Beide Katalysatortypen können, abhängig von der chemischen Natur der Liganden und in unterschiedlicher Aktivität, sowohl ROMP- wie ADMET-Gleichgewichtspolymerisationen von Olefinen durch Metathese begünstigen.
Hérrison und Chauvin[5] klärten den Reaktionsmechanismus der Alkenmetathese auf, wonach in einer reversiblen [2+2]-Cycloaddition eines Metallcarbenkomplexes mit einem Olefin ein Metallacyclobutan gebildet wird, aus dem in einer [2+2] Retrocycloaddition ein neuer Metallcarbenkomplex und ein neues Olefin entsteht. Während bei der acyclischen Dienmetathese-Polymerisation das Gleichgewicht durch die Entfernung eines kleinen Moleküls (Ethen) (entropisch) in Richtung Polymer verschoben und so die Rückreaktion unterdrückt wird, ist die Triebkraft bei der ROMP-Reaktion die Enthalpieänderung durch die Aufhebung der Ringspannung der Cycloalkene.
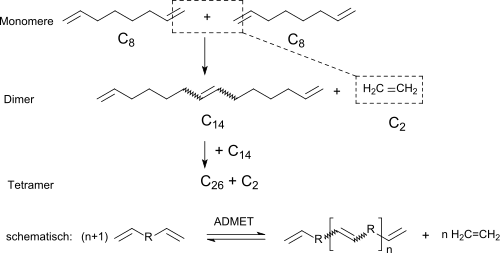
Im Gegensatz zu ROMP werden ADMET-Polymerisationen in Substanz durchgeführt, um konkurrierende Gleichgewichtsreaktionen zu vermeiden und die Freisetzung von Ethen zu erleichtern. Im Gegensatz zu den anderen bekannten Metathesereaktionen handelt es sich bei der Acyclischen Dienmetathese nicht um eine Kettenwachstumsreaktion mit Addition von Monomeren an das aktive Kettenende eines Makromoleküls, sondern um eine Polykondensationsreaktion (unter Metallkomplex-Katalyse), bei der stufenweise Monomere zu Dimeren reagieren, die wiederum zu Tetrameren kondensieren usw. Wie alle Stufenwachstumsreaktionen erfordert auch die ADMET-Reaktion für die Erzielung von Polymeren mit hohen Molmassen sehr hohe Umsätze (>99 % der reaktiven Gruppen). Dieses kinetische Verhalten kontrastiert klar zu einer Kettenwachstumsreaktion, wie z. B. der Polymerisation von Standardolefinen, bei denen Umsetzungsgrade von 90 % bereits hervorragend sind.
Die auf lineare Stufenwachstumsreaktionen anwendbare Carothers-Gleichung:
verknüpft den Polymerisationsgrad (genauer: das Zahlenmittel des Polymerisationsgrads, degree of polymerization, DP) mit dem Umsatzgrad p einer Polykondensationsreaktion. Bei einem Umsatz von 99 % wird ein mittlerer Polymerisationsgrad von 100 erzielt. Erst bei hohem Umsatz erfolgt Verknüpfung zweier hochmolekularer Polymerketten, was die Zahl der Polymermoleküle im Reaktionsraum erheblich verringert. Daraus folgt auch, dass die Katalysatoraktivität über den gesamten Polymerisationszyklus hoch sein muss.
Die Anwesenheit auch geringer Verunreinigungen in den α,ω-Dienmonomeren – insbesondere von Monoolefinen, die zum Wachstumsabbruch (end-capping) führen – reduziert ebenfalls den Polymerisationsgrad dramatisch.
Die modifizierte Carothers-Gleichung mit als dem Anteil Verunreinigungen an der Monomermenge:
ergibt für einen Polymerisationsgrad von 0,99 und einem von 1 % einen von 100 auf 67 reduzierten Polymerisationsgrad.
Daraus folgt, dass hochmolekulare Polymere durch ADMET-Polykondensationen nur erzeugt werden können mit hochreinen Dienmonomeren und bei vollständiger Entfernung des entstehenden Ethens (Durchführung der Reaktion im Vakuum oder Entgasung im Inertgasstrom). Die bei der ADMET-Polyreaktion unter Gleichgewichtsbedingungen erzeugten Polymeren besitzen die wahrscheinlichste Molekulargewichtsverteilung von Polykondensationen, also eine Polydispersität (polydispersity index PDI) Mw / Mn von 2, die einer idealen Schulz-Flory-Verteilung entspricht.
Die durch ADMET-Reaktion gebildeten olefinischen Polymeren liegen vorwiegend (75–95 %, typischerweise >90 %) in der trans-Konfiguration vor.[22]
Da bei ADMET-Reaktionen keine Kettenübertragung wie bei radikalischen Polymerisationen auftritt, werden auch keine verzweigten Polymeren gebildet. Die milden Reaktionsbedingungen und das Fehlen von Nebenreaktionen ermöglichen die Synthese von defektfreien Polymeren mit gut kontrollierbaren Molmassen und Polydispersitäten und somit auch Mikrostrukturen.[23]
Anwendungen
BearbeitenDie ADMET-Polymerisation ermöglicht den kontrollierten Aufbau von linearen Polymeren mit Funktionen oder Strukturen, die durch eine bestimmte Anzahl von Methylengruppen und eine C=C-Doppelbindung getrennt sind. So entsteht z. B. aus Undecenylundecenoat durch ADMET-Polymerisation ein ungesättigter Polyester, bei dem sich alle 20 C-Atome eine Esterfunktion und eine Doppelbindung befindet.[24]
Analog dazu liefert der Sulfonatester Undecenylundecensulfonat bei der ADMET-Polymerisation ungesättigte aliphatische Polysulfonate mit mittleren Molmassen Mn bis 37.000 g·mol−1, die an einem Pd/C-Katalysator glatt zu den entsprechenden gesättigten Polysulfonaten hydriert werden.[25]
Auch Polyurethane sind in gleicher Weise ausgehend von den bio-basierten Ausgangsstoffen 10-Undecensäure bzw. dessen Azid und 10-Undecen-1-ol durch ADMET-Polymerisation darstellbar.[26]
Die durch ADMET-Polymerisation von α,ω-Dienen mit polaren funktionellen Gruppen erreichbaren Molmassen sind in der Regel niedriger als durch radikalische Polymerisation, ermöglichen aber dadurch ihre thermoplastische Verarbeitung, die bei polaren Polykondensaten mit Mn > ca. 30.000 g·mol−1 problematisch wird.
Darüber hinaus sind durch ADMET-Polymerisation Polymere mit definierten Molmassen, wie z. B. eng verteilte und unverzweigte Polyethylene,[23] Copolymere, z. B. Ethylenvinylacetat EVA[27] und mit ungewöhnlichen Primärstrukturen (Polymerarchitekturen), wie z. B. hochverzweigte (hyperbranched) Polymere oder auch Poly-Rotaxane zugänglich.[28][29]
Monomere mit aciden Wasserstoffatomen, z. B. 4-Vinylbenzylphosphonsäure, vergiften ADMET-Polymerisationskatalysatoren, können aber nach Umsetzung mit Schutzgruppen ebenfalls in ADMET-Copolymeren Verwendung finden, die für den zukünftigen Einsatz als protonenleitende Membranen für Brennstoffzellen diskutiert werden.[30]
Die ADMET-Polymerisation findet häufigen Einsatz bei Monomeren aus nachwachsenden Rohstoffen, z. B. Umsetzungsprodukten von 10-Undecensäure, mit Diencharakter.[31][24][12] und ermöglicht auch die Herstellung von Blockcopolymeren mit thermoplastischen Eigenschaften.[32]
Mit der ungesättigten Dicarbonsäure Itaconsäure (durch Fermentation aus Melasse zugänglich) entsteht nach Umsetzung mit 10-Undecen-1-ol und anschließender ADMET-Polymerisation ein ungesättigter Polyester mit freier Vinylgruppe der Itaconsäure, an die Thiole und Amine in einer Michael-Addition addiert werden können.[33]
Funktionalisierte α,ω-Diene, wie z. B. 2-(Undec-10-en-1-yl)tridec-12-en-1-yl-acrylat
können ebenfalls nach Thiol-Michael-Addition und Oxidation des entstandenen Thioethers zum Sulfon in eine Reihe symmetrischer und funktioneller Monomere umgewandelt werden. Die hochmolekularen ADMET-Polymerisationsprodukte können durch Thiol-Klickreaktion an den Doppelbindungen im Polymerrückgrat weiter funktionalisiert werden.[34]
Die ADMET-Polymerisation von α,ω-Dienen in Gegenwart von funktionellen α-Monoolefinen erzeugt Telechele, d. h. Oligomere mit reaktiven Endgruppen,[35] die sich zur Herstellung von Blockcopolymeren eignen.[32]
Literatur
BearbeitenÜbersichtsartikel
- N. F. Sauty, L. C. da Silva, M. D. Schulz, C. S. Few, K. B. Wagener: Review Article: Acyclic diene metathesis polymerization and precision polymers. In: Appl. Petrochem. Res. Band 4, 2014, S. 225–233, doi:10.1007/s13203-014-0045-2.
- P. Atallah, K. B. Wagener, M. D. Schulz: ADMET: The future revealed. In: Macromolecules. Band 46, Nr. 12, 2013, S. 4735–4741, doi:10.1021/ma400067b.
- C. Simocko, P. Atallah, K. B. Wagener: A brief examination of the latest ADMET chemistry. In: Current Organic Chemistry. Band 17, Nr. 22, 2013, S. 2749–2763(15).
- H. Mutlu, L. Montero de Espinosa, M. A. R. Meier: Critical Review: Acyclic diene metathesis: a versatile tool for the construction of defined polymer architectures. In: Chem. Soc. Rev. Band 40, 2011, S. 1404–1445, doi:10.1039/B924852H.
- K. L. Opper, K. B. Wagener: ADMET: Metathesis polycondensation. In: J. Polym. Sci. Part A: Polym. Chem. Band 49, Nr. 4, 2011, S. 821–831, doi:10.1002/pola.24491.
- R. R. Schrock: Recent advances in high oxidation state Mo and W imido alkylidene chemistry. In: Chem. Rev. Band 109, Nr. 8, 2009, S. 3211–3226, doi:10.1021/cr800502p.
- T. W. Baughman, K. B. Wagener: Recent advances in ADMET polymerization. In: Adv. Polym. Sci.: Metathesis Polymerization. Band 176. Springer, 2005, ISBN 3-540-23358-X, S. 1–42, doi:10.1007/b101315.
- S. E. Lehman Jr, K. B. Wagener: Catalysis in acyclic diene metathesis diene (ADMET) polymerization. In: B. Rieger, L. S. Baugh, S. Kacker, S. Stiegler (Hrsg.): Late transition metal polymerization catalysis. Wiley-VCH, 2003, ISBN 3-527-30435-5, S. 193–230.
Einzelnachweise
Bearbeiten- ↑ a b K. B. Wagener, J. M. Boncella, J. G. Nel: Acyclic diene metathesis (ADMET) polymerization. In: Macromolecules. Band 24, Nr. 10, 1991, S. 2649–2657, doi:10.1021/ma00010a001.
- ↑ J. E. O‘Gara, K. B. Wagener, S. F. Hahn: Acyclic diene metathesis (ADMET) polymerization. Synthesis of perfectly linear polyethylene. In: Makromol. Chem., Rapid Commun. Band 14, Nr. 10, 1993, S. 657–662, doi:10.1002/marc.1993.030141006.
- ↑ Evonik Industries, Vestenamer 8012: The rubber additive with unique properties, PDF ( vom 27. Februar 2015 im Internet Archive)
- ↑ N. Calderon, H. Y. Chen, K. W. Scott: Olefin metathesis - A novel reaction for skeletal transformations of unsaturated hydrocarbons. In: Tetrahedron Lett. Band 34, 1967, S. 3327–3329, doi:10.1016/S0040-4039(01)89881-6.
- ↑ a b J.-L. Hérrison, Y. Chauvin: Catalysis of olefin transformations by tungsten complexes. II. Telomerization of cyclic olefins in the presence of acyclic olefins. In: Makromol. Chem. Band 141, 1971, S. 161–176, doi:10.1002/macp.1971.021410112.
- ↑ M. Lindmark-Hamberg, K. B. Wagener: Acyclic metathesis polymerization: the olefin metathesis reaction of 1,5-hexadiene and 1,9-decadiene. In: Macromolecules. Band 20, Nr. 11, 1987, S. 2949–2951, doi:10.1021/ma00177a053.
- ↑ C. J. Schaverien, J. C. Dewan, R. R. Schrock: Multiple metal-carbon bonds. 43. Well-characterized, highly active, Lewis acid free olefin metathesis catalysts. In: J. Amer. Chem. Soc. Band 108, Nr. 10, 1986, S. 2771–2773, doi:10.1021/ja00270a056.
- ↑ J. S. Murdzek, R. R. Schrock: Well-characterized olefin metathesis catalysts that contain molybdenum. In: Organometallics. Band 6, 1987, S. 1373–1374, doi:10.1021/om00149a048.
- ↑ D. W. Smith, Jr., K. B. Wagener: Acyclic diene metathesis (ADMET) polymerization. Design and synthesis of unsaturated poly(carbosiloxanes). In: Macromolecules. Band 26, Nr. 7, 1993, S. 1633–1642, doi:10.1021/ma00059a022.
- ↑ S. T. Nguyen, L. K. Johnson, R. H. Grubbs, J. W. Ziller: Ring-opening metathesis polymeriszation (ROMP) of norbornene by a Group VIII carbine complex in protic media. In: J. Am. Chem. Soc. Band 114, Nr. 10, 1992, S. 3974–3975, doi:10.1021/ja00033a053.
- ↑ K. Brzezinska, P. S. Wolfe, M. D. Watson, K. B. Wagener: Acyclic diene metathesis (ADMET) polymerization using a well-defined ruthenium based metathesis catalyst. In: Macomol. Chem. Phys. Band 197, Nr. 6, 1996, S. 2065–2074, doi:10.1002/macp.1996.021970622.
- ↑ a b P. A. Foukou, M. A. R Meier: Use of a renewable and degradable monomer to study the temperature-dependent olefin isomerization during ADMET polymerizations. In: J. Amer. Chem. Soc. Band 131, Nr. 5, 2009, S. 1664–1665, doi:10.1021/ja808679w.
- ↑ M. Scholl, S. Ding, C. W. Lee, R. H. Grubbs: Synthesis and activity of a new generation of ruthenium-based olefin metathesis catalysts coordinated with 1,3-dimesityl-4,5-dihydroimidazol-2-ylidene ligands. In: Org. Lett. Band 1, Nr. 6, 1999, S. 953–956, doi:10.1021/ol990909q.
- ↑ P. A. Foukou, M. A. R Meier: Studying and suppressing olefin isomerization side reactions during ADMET polymerizations. In: Macromol. Rapid Commun. Band 31, Nr. 4, 2010, S. 368–373, doi:10.1002/marc.200900678.
- ↑ J. J. Van Veldhuizen, S. B. Garber, J. S. Kingsbury, A. H. Hoveyda: A recyclable chiral Ru catalyst for enantioselective olefin metathesis. Efficient catalytic asymmetric ring-opening/cross metathesis in air. In: J. Am. Chem. Soc. Band 124, Nr. 18, 2002, S. 4954–4955, doi:10.1021/ja020259c.
- ↑ G. C. Vougioukalakis, R. H. Grubbs: Ruthenium-based heterocyclic carbene-coordinated olefin metathesis catalysts. In: Chem. Rev. Band 110, Nr. 3, 2002, S. 1746–1787, doi:10.1021/cr9002424.
- ↑ F. C. Courchey, J. C. Sworen, A. Coronado, R. B. Wagener: The utility of Hoveyda-type catalysts in ADMET chemistry: Sterics versus electronics. In: J. Mol. Catal. A: Chemical. Band 254, Nr. 1–2, 2006, S. 111–117, doi:10.1016/j.molcata.2006.02.073.
- ↑ J. A. Love, J. P. Morgan, T. M. Trnka, R. H. Grubbs: A practical and highly active Ruthenium-based catalyst that effects the cross metathesis of acrylonitrile. In: Angew. Chem. Int. Ed. Band 41, Nr. 21, 2002, S. 4035–4037, doi:10.1002/1521-3773(20021104)41:21<4035::AID-ANIE4035>3.0.CO;2-I.
- ↑ I. C. Stewart, C. J. Douglas, R. H. Grubbs: Increased efficiency in cross-metathesis reactions of sterically hindered olefins. In: Org. Lett. Band 10, Nr. 3, 2008, S. 441–444, doi:10.1021/ol702624n.
- ↑ O. Kreye, T. Tóth, M. A. R. Meier: Poly-α,β-unsaturated aldehydes derived from castor oil via ADMET polymerization. In: Eur. J. Lipid Sci. Technol. Band 113, Nr. 1, 2011, S. 31–38, doi:10.1002/ejlt.201000108.
- ↑ V. Dragutan, I. Dragutan, A. T. Balaban: 2005 Nobel Prize in Chemistry: AWARDED FOR THE DEVELOPMENT OF THE METATHESIS REACTION IN ORGANIC SYNTHESIS. In: Platinum Metals Rev. Band 50, Nr. 1, 2006, S. 35–37, doi:10.1595/147106706x94140 (2005 Nobel Prize in Chemistry: AWARDED FOR THE DEVELOPMENT OF THE METATHESIS REACTION IN ORGANIC SYNTHESIS).
- ↑ K. B. Wagener, D. W. Smith: Acyclic diene metathesis polymerization: synthesis and characterization of unsaturated poly[carbo(dimethyl)silanes]. In: Macromolecules. Band 24, Nr. 23, 1991, S. 6073–6078, doi:10.1021/ma00023a004.
- ↑ a b T. W. Baughman, K. B. Wagener: Recent advances in ADMET polymerization. In: Adv. Polym. Sci.: Metathesis Polymerization. Band 176. Springer, 2005, ISBN 3-540-23358-X, S. 1–42, doi:10.1007/b101315.
- ↑ a b A. Rybak, M. A. R. Meier: Acyclic diene metathesis with a monomer from renewable resources: Control of molecular weight and one-step preparation of block copolymers. In: ChemSusChem. Band 1, Nr. 6, 2008, S. 542–547, doi:10.1002/cssc.200800047.
- ↑ R. R. Parkhurst, S. Balog, C. Weder, Y. C. Simon: Synthesis of poly(sulfonate ester)s by ADMET polymerization. In: RSC Adv. Band 4, Nr. 96, 2014, S. 53967–53974, doi:10.1039/C4RA08788G.
- ↑ T. Lebarbé, A.S. More, P.S. Sane, E. Grau, C. Alfos, H. Cramail: Bio-based aliphatic polyurethanes through ADMET polymerization in bulk and green solvent. In: Macromol. Rapid Commun. Band 35, Nr. 4, 2014, S. 479–483, doi:10.1002/marc.201300695.
- ↑ M. D. Watson, K. B. Wagener: Ethylene/vinyl acetate copolymers via acyclic diene metathesis polymerization. Examining the effect of „long“ precise ethylene run lengths. In: Macromolecules. Band 33, Nr. 15, 2000, S. 5411–5417, doi:10.1021/ma9920689.
- ↑ N. Momcilovic, P. G. Clark, A. J. Boydston, R. H. Grubbs: One-pot synthesis of polyrotaxane via acyclic diene metathesis polymerization of supramolecular monomers. In: J. Am. Chem. Soc. Band 133, Nr. 47, 2011, S. 19087–19089, doi:10.1021/ja208515r.
- ↑ M. D. Schulz, K. B. Wagener: Precision polymers through ADMET polymerizations. In: Macromol. Chem. Phys. Band 215, Nr. 20, 2014, S. 1936–1945, doi:10.1002/macp.201400268.
- ↑ D. Markova, K. L. Opper, M. Wagner, M. Klapper, K. B. Wagener, K. Müllen: Synthesis of proton conducting phosphonic acid-functionalized polyolefins by the combination of ATRP and ADMET. In: Polym. Chem. Band 4, 2013, S. 1351–1363, doi:10.1039/C2PY20886E.
- ↑ H. Mutlu, L. Montero de Espinosa, M. A. R. Meier: Critical Review: Acyclic diene metathesis: a versatile tool for the construction of defined polymer architectures. In: Chem. Soc. Rev. Band 40, 2011, S. 1404–1445, doi:10.1039/B924852H.
- ↑ a b T. C. Mauldin, E. F. Spiegel, M. R. Kessler: Block copolymers derived from the acyclic diene metathesis (ADMET) polymerization of a modified vegetable oil. In: Polymer Preprints. Band 52, Nr. 1, 2011, S. 107–108 (online ( vom 24. Februar 2015 im Internet Archive) [PDF; abgerufen am 27. Januar 2015]).
- ↑ A. Lv, Z.-L. Li, F.-S. Du, Z.-C. Li: Synthesis, functionalization, and controlled degradation of high molecular weight polyester from itaconic acid via ADMET polymerization. In: Macromolecules. Band 47, Nr. 22, 2014, S. 7707–7716, doi:10.1021/ma5020066.
- ↑ J. A. van Hensbergen, T. W. Gaines, K. B. Wagener, R. P. Burford, A. B. Lowe: Functional α,ω-dienes via thiol-Michael chemistry: synthesis, oxidative protection, acyclic diene metathesis (ADMET) polymerization and radical thiol–ene modification. In: Polym. Chem. Band 5, Nr. 10, 2014, S. 6225–6235, doi:10.1039/C4PY00783B.
- ↑ J. E. Schwendeman, R. B. Wagener: Synthesis of amorphous hydrophobic telechelic hydrocarbon diols via ADMET polymerization. In: Macromol. Chem. Phys. Band 210, Nr. 21, 2009, S. 1818–1833, doi:10.1002/macp.200900270.