Olefine
 Ethen |
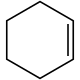 Cyclohexen, ein Cycloolefin |
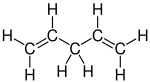 1,4-Pentadien, ein Dien |
 2-Methyl-2-buten, ein Isoolefin |
1-Penten, ein α-Olefin |
Olefine ist ein besonders in der petrochemischen Industrie verwendeter Oberbegriff für alle acyclischen und cyclischen Kohlenwasserstoffe mit einer oder mehreren Kohlenstoff-Kohlenstoff-Doppelbindungen. Ausgenommen davon sind aromatische Verbindungen. Als Olefine gelten alle Alkene, Cycloalkene und Polyene.[1] Aus Olefinen lässt sich durch Polymerisation, Alkylierung von Paraffinen, substituierende oder addierende Chlorierung, durch Hydratisierung, durch Addition von Schwefelwasserstoff, durch die Addition von Aldehyden mittels Prins-Reaktion, durch die Reppe-Chemie, über die Hydroformylierung, die Alkylierung von Aromaten und viele andere Reaktionen eine breite Palette von Folgeprodukten wie Polyolefine, Alkohole, Mercaptane, Carbonsäuren, Aldehyde und andere herstellen.
Die Bezeichnung „Olefine“ leitet sich angeblich vom französischen Ausdruck „gaz oléfiant“, ölbildendes Gas, ab, der dem 1669[2] entdeckten Ethen zugedacht wurde, weil aus der Reaktion von Ethen und Chlor „öliges“ 1,2-Dichlorethan entsteht.[3]
Darstellung und Gewinnung Bearbeiten
Olefine lassen sich gezielt durch verschiedene Verfahren herstellen; zum Teil fallen sie bei anderen Prozessen als Neben- oder Koppelprodukt an.
Direkte Herstellung Bearbeiten
Dehydrierung von Paraffinen Bearbeiten
Die Dehydrierung von Paraffinen kann sowohl thermisch als auch katalytisch durchgeführt werden. Ein großtechnischer Prozess ist die Dehydrierung von Ethylbenzol zu Styrol.
Pyrolyse von aliphatischen Kohlenwasserstoffen Bearbeiten
Die Pyrolyse von aliphatischen Kohlenwasserstoffen kann ebenfalls sowohl thermisch als auch katalytisch durchgeführt werden. Zielprodukte beim Cracken sind neben Benzin vor allem kurzkettige Olefine wie Ethen und Propen.
Katalytische Dehydrierung von Alkoholen Bearbeiten
Die Abspaltung von Wasser aus Alkoholen führt zu Olefinen. Die Reaktionsraten der Wasserabstraktion steigen in der Reihenfolge tertiäre > sekundäre > primäre Alkohole.
Methanol-to-Olefins Bearbeiten
Beim Methanol-to-Olefins-Verfahren wird aus Methanol an einem Zeolith-Katalysator über das Zwischenprodukt Dimethylether eine Mischung aus Ethen und Propen hergestellt.[4]
Anfall als Koppel- oder Nebenprodukt Bearbeiten
Olefine fallen bei vielen Raffinerieprozessen als Nebenprodukte an.
Fischer-Tropsch-Synthese Bearbeiten
Bei der Fischer-Tropsch-Synthese fallen in der C3/C4-Fraktion etwa 25 bis 45 % Olefine an.
Kohleverkokung Bearbeiten
Bei der Kohleverkokung fallen Ethen sowie Propen und Butene an.
Eigenschaften Bearbeiten
Unter Verwendung des Monohydrats des Bortrifluorid als Katalysator lassen sich n-Olefine zu Isoolefinen isomerieren. Isoolefine eignen sich etwa als Wasserstoffakzeptor bei der Dehydroalkylierung von Aromaten mit Isobutan.[5]
Olefine reagieren mit Schwefelsäure zu Alkylsulfaten. Im sauren Medium reagieren diese mit Wasser zu Alkoholen unter Rückbildung der Schwefelsäure. Isoolefine wie Isobuten (2-Methyl-1-propen) reagieren besonders leicht, in 65%iger Schwefelsäure etwa 500-mal schneller als n-Buten.[6]
Verwendung Bearbeiten
Neben Ethen und Propen als Rohstoff für Polyolefine wie Polyethylen und Polypropylen sind α-Olefine für die Modifikation der Kristallinität in Polyolefinen von Bedeutung. α-Olefine werden durch Oligomerisierung von Ethen im Shell Higher Olefin Process hergestellt und über die Hydroformylierung zu Fettalkoholen umgesetzt. Diese finden Verwendung als Tenside.[7]
Siehe auch Bearbeiten
Einzelnachweise Bearbeiten
- ↑ Eintrag zu olefins. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.O04281 – Version: 2.3.3.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14.
- ↑ Eintrag zu Dichlorethane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juni 2014.
- ↑ Makarand R. Gogate: Methanol-to-olefins process technology: current status and future prospects. In: Petroleum Science and Technology. 37, 2019, S. 559, doi:10.1080/10916466.2018.1555589.
- ↑ Joe T. Kelly, Robert J. Lee: Dehydroalkylation of Aromatics with Isoparaffins. In: Industrial & Engineering Chemistry. 47, 1955, S. 757–763, doi:10.1021/ie50544a033.
- ↑ Friedrich Asinger: Chemie und Technologie der Monoolefine. Reprint 2021 Auflage. Akademie-Verlag, Berlin 1957, ISBN 978-3-11-256882-8, S. 556–558, doi:10.1515/9783112568828.
- ↑ E. F. Lutz: Shell higher olefins process. In: Journal of Chemical Education. 63, 1986, S. 202, doi:10.1021/ed063p202.