Thiazyltrifluorid
chemische Verbindung
Thiazyltrifluorid ist eine chemische Verbindung aus der Gruppe der Fluoride.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
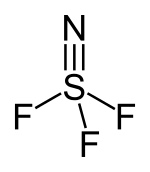
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Thiazyltrifluorid | ||||||||||||
| Andere Namen |
Difluorsulfiminfluorid | ||||||||||||
| Summenformel | F3NS | ||||||||||||
| Kurzbeschreibung | |||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 103,07 g·mol−1 | ||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||
| Dichte |
1,92 g·cm−3 (−80 °C)[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
−27,1 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Gewinnung und Darstellung
BearbeitenThiazyltrifluorid kann durch Reaktion von Tetraschwefeltetranitrid mit Silber(II)-fluorid gewonnen werden.[1]
Es kann auch aus Ammoniak und Dischwefeldecafluorid dargestellt werden.[4]
Eigenschaften
BearbeitenThiazyltrifluorid ist ein farbloses, thermisch stabiles, stechend riechendes[2] Gas, das mit Wasser langsam hydrolysiert. Mit Natriumhydroxid reagiert es rasch zu Ammonium-, Fluor- und Sulfit-Ionen.[1] Die Verbindung ist viel stabiler als Thiazylfluorid und reagiert bei Raumtemperatur nicht mit Ammoniak, selbst beim Erhitzen nicht mit Chlorwasserstoff und unterhalb von 400 °C auch nicht mit Natrium.[5]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 206.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 609.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Steve Mitchell (1996). Steve Mitchell, ed. Biological interactions of sulfur compounds. CRC Press. p. 14. ISBN 0-7484-0245-4.
- ↑ James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie: Prinzipien von Struktur und Reaktivität. Walter de Gruyter, 2003, ISBN 3-11-017903-2, S. 1021 (eingeschränkte Vorschau in der Google-Buchsuche).