Sotagliflozin
Sotagliflozin ist ein orales Antidiabetikum für Typ-1-Diabetiker mit Übergewicht, bei denen Insulin allein nicht zu einer ausreichenden Blutzuckerkontrolle ausreicht. Es wurde von Sanofi und Lexicon Pharmaceuticals entwickelt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
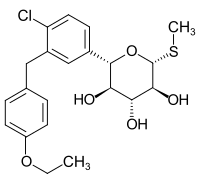
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sotagliflozin | |||||||||||||||||||||
| Andere Namen |
(2S,3R,4R,5S,6R)-2-{4-Chlor-3-[(4-ethoxyphenyl)methyl]phenyl}-6-(methylsulfanyl)oxan-3,4,5-triol | |||||||||||||||||||||
| Summenformel | C21H25ClO5S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 424,94 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt |
130 °C[2] | |||||||||||||||||||||
| Löslichkeit |
löslich in DMSO, DMF und Ethanol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Wirkung
BearbeitenSotagliflozin ist ein SGLT1- und SGLT2-Inhibitor. Als SGLT1-Inhibitor verlangsamt es die Aufnahme von Glucose und Galactose, wodurch Hyperglykämien nach dem Essen vermieden werden können. Als SGLT2-Inhibitor verhindert Sotagliflozin die Rückresorption von Glucose über die Nieren, wodurch Glucose über den Urin ausgeschieden wird (Glucosurie).[4][5][6][7] In Studien konnte gezeigt werden, dass Sotagliflozin den HbA1c reduzieren kann.[7]
Nebenwirkungen
BearbeitenZu den häufigsten Nebenwirkungen gehören Infektionen im Genitalbereich, diabetische Ketoazidose und Durchfall.[7] Besonders das erhöhte Risiko für eine diabetische Ketoazidose ist bedenklich, da diese normalerweise mit einer Hyperglykämie einhergeht. Bei Einnahme von Sotagliflozin ist dies jedoch nicht immer der Fall.[6]
Zulassung
BearbeitenSotagliflozin wurde 2019 in der EU für übergewichtige (BMI > 27 kg/m2) Typ-1-Diabetiker zugelassen, die trotz optimaler Insulintherapie keine adäquate Blutzuckereinstellung erreichen.[7] Im Mai 2022 wurde die Zulassung auf Antrag des Zulassungsinhabers zurückgenommen.[8] Die Food and Drug Administration (FDA) verweigerte die Zulassung in dieser Indikation.[9]
2023 wurde Sotagliflozin in den USA unter dem Namen Inpefa zugelassen. Das Anwendungsgebiet umfasst die Verringerung des Risikos eines kardiovaskulären Todes oder einer Krankenhauseinweisung aufgrund von Herzinsuffizienz bei Erwachsenen mit Herzinsuffizienz oder mit Typ-2-Diabetes mellitus, chronischer Nierenerkrankung und anderen kardiovaskulären Risikofaktoren.[10][11]
Handelsname
BearbeitenZynquista (EU; zurückgezogen), Inpefa (USA)
Einzelnachweise
Bearbeiten- ↑ a b Cayman Chemical: Sotagliflozin (LP 802034, LX4211, CAS Number: 1018899-04-1) | Cayman Chemical, abgerufen am 27. Januar 2022
- ↑ Patentanmeldung WO2018067805A1: Solid state forms of Sotagliflozin. Angemeldet am 5. Oktober 2017, veröffentlicht am 12. April 2018, Anmelder: Teva Pharma, Erfinder: Stefano Luca Giaffreda et al.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Bernt Johan von Scholten, Frederik F. Kreiner, Stephen C. L. Gough, Matthias von Herrath: Current and future therapies for type 1 diabetes. In: Diabetologia. Band 64, Nr. 5, Mai 2021, S. 1037–1048, doi:10.1007/s00125-021-05398-3, PMID 33595677, PMC 8012324 (freier Volltext).
- ↑ Joseph I. Wolfsdorf, Robert E. Ratner: SGLT Inhibitors for Type 1 Diabetes: Proceed With Extreme Caution. In: Diabetes Care. Band 42, Nr. 6, Juni 2019, S. 991–993, doi:10.2337/dci19-0008.
- ↑ a b Rene Belder: Sotagliflozin as an Adjunct to Insulin for Type 1 Diabetes. 17. Januar 2019, abgerufen am 19. Oktober 2021.
- ↑ a b c d Europäische Arzneimittelagentur: Zynquista - Zusammenfassung der Merkmale des Arzneimittels. Abgerufen am 20. Oktober 2021.
- ↑ Zynquista, Withdrawal of the marketing authorisation in the European Union, EMA, 19. Mai 2022.
- ↑ Food and Drug Administration: Proposal To Refuse To Approve a New Drug Application for Sotagliflozin Oral Tablets, 200 Milligrams and 400 Milligrams; Opportunity for a Hearing. 3. März 2021, abgerufen am 19. Oktober 2021.
- ↑ Inpefa (sotagliflozin) FDA Approval History, drugs.com, abgerufen am 14. Juni 2023.
- ↑ NDA 216203, abgerufen am 14. Juni 2023,