Profoxydim
Profoxydim ist ein Gemisch mehrerer isomerer chemischen Verbindungen aus der Gruppe der Cyclohexenoxime.[1] Profoxydim wurde 1998 von BASF eingeführt.[5]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
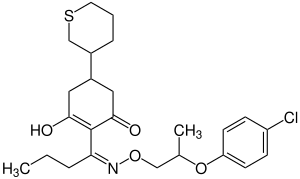
| ||||||||||||||||||||||
| Komplexes Isomerengemisch – vereinfachte Strukturformel ohne Angaben zur Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Profoxydim | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C24H32ClNO4S | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 466,03 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||||||||
| Dichte |
1,198 g·cm−3[1] | |||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Eigenschaften
BearbeitenProfoxydim ist eine farb- und geruchlose Flüssigkeit. Sie ist stabil gegenüber Hydrolyse und Photolyse, wandelt sich aber abhängig vom pH-Wert durch Oxidation in Sulfoxide um (DT50-Wert zwischen 30 und 300 Tagen).[1]
Stereochemie
BearbeitenDas Profoxydim-Molekül weist mehrere Stereozentren auf: So sind die Kohlenstoffatome C-2 (in der Isopropylgruppe) und C-5 (Verknüpfungsatom des Tetrahydrothiopyranrests) asymmetrisch substituiert und daher chiral; an der Oxim-Gruppierung kann zudem (EZ)-Isomerie auftreten. Im Cyclohexanon-Ring liegt eine Enol-Gruppierung vor, die Keto-Enol-Tautomerie ermöglicht. Die Isomere werden in der Regel als Gemisch eingesetzt.
Wirkung
BearbeitenDer Wirkstoff hemmt die Acetyl-CoA-Carboxylase in der Fettsäure-Biosynthese.[5]
Verwendung
BearbeitenProfoxydim wird als systemisches Herbizid im Reisanbau verwendet.[1][5]
Zulassung
BearbeitenIn einigen Staaten der EU sind Pflanzenschutzmittel mit diesem Wirkstoff zugelassen, nicht jedoch in Deutschland, Österreich oder der Schweiz.[6]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k l Active substance | Profoxydim. In: EU Pesticides Database (v.2.2). 17. Juni 2011, abgerufen am 20. August 2021 (englisch, PDF zum Herunterladen).
- ↑ Eintrag zu Profoxydim in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- ↑ Eintrag zu 2-{(EZ)-1-[(2RS)-2-(4-chlorophenoxy)propoxyimino]butyl}-3-hydroxy-5-(thian-3-yl)cyclohex-2-en-1-one im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Profoxydim lithium salt bei Sigma-Aldrich, abgerufen am 22. Mai 2017 (PDF).
- ↑ a b c Eintrag zu Profoxydim. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. März 2015.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Profoxydim in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 25. März 2016.

