N-Isopropylacrylamid
N-Isopropylacrylamid ist ein N-substituiertes Acrylamid, dessen Stickstoffatom eine Isopropylgruppe trägt. Die Substanz hat als Monomer für Thermoresponsive Polymere bzw. temperatur- und pH-empfindliche Hydrogele bildendes Poly(N-Isopropylacrylamid) großes Interesse gefunden.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
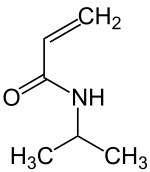
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | N-Isopropylacrylamid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H11NO | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 113,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Methanol, und Essigsäureisopropylester[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Herstellung
BearbeitenWegen der teuren Reaktanden eher für die Synthese im Labor geeignet ist die Reaktion von Acryloylchlorid mit überschüssigem Isopropylamin,
bei der Produktausbeuten von über 80 % erzielt werden.[6]
Auch die Reaktion von Acrylamid mit überschüssigem 2-Brompropan führt zu unbefriedigenden Ausbeuten an NIPAM von ca. 66 %.[7]
In einem Gemisch von konzentrierter Schwefelsäure mit Essigsäure reagiert Propen mit Acrylnitril bei 80 °C zu N-Isopropylacrylamid.[4]
In derselben Patentschrift[4] ist der übliche industrielle Herstellungsweg des N-Isopropylacrylamids in einer Ritter-Reaktion von Acrylnitril mit Isopropanol in Gegenwart von konzentrierter Schwefelsäure beschrieben.
In Abhängigkeit von Reaktionstemperatur und -dauer werden Ausbeuten von 90 % bis „nahezu quantitativ“ erreicht.
Eine Variante dieser Reaktion mit einem sauren Zeolith-Katalysator zur Erzeugung des Carbeniumions aus Isopropanol liefert NIPAM in 93-prozentiger Ausbeute.[8]
Zur Unterdrückung der Polymerisation in Lösung werden den Reaktionsgemischen häufig Inhibitoren, wie z. B. Phenothiazin oder 4-Methoxyphenol (MEHQ) zugegeben.
Eigenschaften
BearbeitenN-Isopropylacrylamid fällt bei der Synthese als weißer bis cremefarbener kristalliner Feststoff an, der bei der Lagerung bei höheren Temperaturen zur Polymerisation neigt und daher oft mit Polymerisationsinhibitoren versetzt wird.[3]
Anwendungen
BearbeitenDie Homopolymerisation von N-Isopropylacrylamid, z. B. mit AIBN als Radikalinitiator liefert das wasserlösliche Poly(N-Isopropylacrylamid), dessen solvatisierte lineare Polymerketten bei Temperaturerhöhung oberhalb der so genannten unteren kritischen Mischungstemperatur (englisch lower critical solution temperature, LCST) zu einem dichten Knäuel kollabieren.[9]
In Gegenwart des Vernetzers N,N′-Methylenbisacrylamid können durch radikalische Polymerisation von N-Isopropylacrylamid wasserquellbare und thermosensitive Smarte Hydrogele erzeugt werden, die oberhalb der so genannten Volumenübergangstemperatur (engl. volume phase transition temperature, VPTT) von 33 °C dramatisch schrumpfen.[5] Die LCST von linearen Polymeren liegt nahe der VPTT von quervernetzten Hydrogelen, d. h. das Hydrogel verhält sich annähernd wie eine konzentrierte Polymerlösung.[10]
Durch Copolymerisation mit z. B. Acrylsäure und Vernetzung sind sowohl thermo- als auch pH-sensitive Hydrogele zugänglich.
Anwendungen dieser smarten Hydrogele auf der Basis von N-Isopropylacrylamid-Copolymeren liegen u. a. in der gesteuerten Wirkstofffreisetzung (engl. controlled drug release).[11]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu ISOPROPYLACRYLAMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. September 2021.
- ↑ a b c d e f g Datenblatt N-Isopropylacrylamide bei Sigma-Aldrich, abgerufen am 25. November 2015 (PDF).
- ↑ a b c d e Eintrag zu N-Isopropylacrylamide (stabilized with MEHQ) bei TCI Europe, abgerufen am 25. November 2015.
- ↑ a b c Patent US2719176: Continuous method of making N-substituted amines. Angemeldet am 5. Februar 1953, veröffentlicht am 27. September 1955, Anmelder: Eastman Kodak Co., Erfinder: H.W. Coover, Jr., N.H. Shearer, Jr..
- ↑ a b G. Panambur, I. Koltover, S. Batchelle, Designing temperature and pH sensitive NIPAM based polymers
- ↑ Patent CN101239927: Angemeldet am 7. Februar 2007, veröffentlicht am 21. März 2012, Anmelder: 重庆融海超声医学工程研究中心有限公司, Erfinder: 叶方伟, 王智彪, 田耘博 (englischer Titel: Method for preparing monomer of temperature-sensitive polyisopropylacrylamide).
- ↑ Patent US4835312: Production process of N-substituted amide compounds. Angemeldet am 2. Juli 1986, veröffentlicht am 30. Mai 1989, Anmelder: 501 Mitsui Chemicals, Inc., Erfinder: H. Itoh, T. Nakagawa, A. Nitta.
- ↑ X. Chen, H. Matsuda, T. Okuhara: Efficient catalytic synthesis of N-isopropyl acrylamide from acrylonitrile and isopropanol. In: Chem. Lett. Band 8, 1999, S. 799–800, doi:10.1016/S0926-860X(00)00629-3.
- ↑ Y. Okada, F. Tanaka: Cooperative Hydration, Chain Collapse, and Flat LCST Behavior in Aqueous Poly(N-isopropylacrylamide) Solutions. In: Macromolecules. Band 38, Nr. 10, 2005, S. 4465–4471, doi:10.1021/ma0502497.
- ↑ M. Constantin, M. Cristea, P. Ascenzi, G. Fundueanu: Lower critical solution temperature versus volume phase transition temperature in thermoresponsive drug delivery systems. In: eXPRESS Polym. Lett. Band 5, Nr. 10, 2011, S. 839–848, doi:10.3144/expresspolymlett.2011.83.
- ↑ F. Eeckman, A.J. Moes, K. Amighi: Poly(N-Isopropylacrylamide) copolymers for constant temperature controlled drug delivery. In: Int. J. Pharm. Band 273, Nr. 1–2, 2004, S. 109–119, doi:10.1016/ijpharm.2003.12.013.
