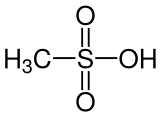
Methansulfonsäure (MSA, von englisch methanesulfonic acid) ist die einfachste Sulfonsäure. Die organischen Salze und Ester der Methansulfonsäure werden als Methansulfonate oder Mesylate bzw. Mesilate bezeichnet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methansulfonsäure | |||||||||||||||
| Andere Namen |
Methylsulfonsäure (MSS) | |||||||||||||||
| Summenformel | CH4O3S | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, viskose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 96,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest oder flüssig[2] | |||||||||||||||
| Dichte |
1,48 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
100 mPa (23 °C)[3] | |||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Darstellung
BearbeitenMethansulfonsäure lässt sich über eine Reihe von Reaktionen im Labormaßstab darstellen; so z. B. durch Oxidation von Methanthiol oder Dimethyldisulfid mit Chlor, Sauerstoff oder Salpetersäure. Eine weitere Reaktionsvariante stellt die Umsetzung von Natriumsulfit mit Dimethylsulfat in wässriger Lösung bei 100 °C und pH größer 6 dar, die Ausbeuten an Methansulfonsäure von 75–85 % liefert.[9]
Die Reaktion von Schwefeltrioxid mit Methan ist möglich, lieferte lange Zeit aber nur geringe Ausbeuten.[10][11][12] Neueste Arbeiten beschreiben Hochdruckreaktionen in Rührkesselreaktoren oder (halb)kontinuierlichen Durchflussreaktoren in Gegenwart von radikalischen Initiatoren wie Dialkylsulfonylperoxiden,[13] insbesondere Bis(methansulfonyl)peroxid CH3-SO2-O-O-SO2-CH3 (DMSP)[14] oder Monomethylsulfonylperoxiden,[15]
bei denen Ausbeuten an Methansulfonsäure von über 90 % erzielt werden können.
Industriell erfolgt die Herstellung vor allem durch Oxidation von Methanthiol oder Dimethyldisulfid mit Chlor.[16] Darüber hinaus wird seit einigen Jahren MSA großtechnisch auch über katalytische Oxidation von Dimethyldisulfid mit Luftsauerstoff und Salpetersäure gewonnen.[17][18]
Die Umsetzung von Methan mit Schwefeltrioxid wurde 2016 zur großtechnischen Produktionsreife geführt.[12] Erste Produktionsanlagen wurden 2022 in Betrieb genommen.[19]
Eigenschaften
BearbeitenMethansulfonsäure ist eine starke Säure, ihr pKS-Wert wird mit −0,6[20] oder dem wahrscheinlicheren −1,9 angegeben. Sie ist mit Wasser in jedem Verhältnis mischbar und kann selbst als Lösemittel dienen.[21] Die kryoskopische Konstante beträgt 5,69 K.[22] Bei Normaldruck zersetzt sich die nur sehr schwer entzündliche MSA unter Luftatmosphäre ab etwa 220 °C zu Kohlenmonoxid, Kohlendioxid, Schwefeltrioxid und Wasser. Der Dampfdruck ist unter Standardbedingungen mit 5,4265 · 10−5 hPa ähnlich niedrig wie der von Schwefelsäure.[3][23] MSA wirkt auch in hohen Konzentrationen nicht oxidierend. Mit der Säurestärke korreliert die hohe Leitfähigkeit wässriger MSA-Lösungen, die bei 20–40 Gew.-% mit über 500 mS/cm ihr Maximum findet und vergleichbar mit der anorganischer Säuren ist.[3][23] Aufgrund von Autoprotolyse leitet reine MSA den elektrischen Strom:
Der beobachtete Protonentransfermechanismus[24] zwischen den Ionen ist mit dem anderer Sulfonsäuren vergleichbar.[25][26][27] Nach wenigen Tagen an der Luft stellt sich bei 70–100%igen Ansätzen eine MSA-Konzentration von etwa 49 % ein. Ähnlich wie Schwefelsäure wirkt MSA stark wasserentziehend und kann somit organische Stoffe verkohlen, die Hydroxygruppen enthalten. Auf dieser Eigenschaft beruht die leicht gelbbraune Färbung der MSA, die gelegentlich beobachtet werden kann. Durch heißes Wasser oder heiße wässrige Alkalien lässt sich MSA nicht hydrolysieren. Das elektrochemische Fenster der MSA ist recht breit – bei einer angelegten Spannung von −1,40 V findet eine Reduktion der Säureprotonen statt, bei +2,35 V eine oxidative Zersetzung der Säure. Sie wirkt nur wenig korrosiv und vermag selbst in hoher Konzentration bei Temperaturen um 100 °C nicht, Oxidschichten von Metallen wie bspw. Aluminium, Titan oder Niob aufzulösen.[3][23]
INN-Nomenklatur
BearbeitenIm medizinischen und pharmazeutischen Bereich lautet die international anerkannte Kurzform für das Anion der Methansulfonsäure (Methansulfonat) gemäß den INN-Regeln „Mesilat“.[28] Solche Kurzformen werden für Molekülkomponenten angelegt, wenn ihre systematische Bezeichnung zu lang ist. Durch Kombination einer Kurzform mit dem INN der wirksamen Komponente des Arzneistoffs entsteht der „modifizierte INN“ (INNm). Ein Beispiel ist der Arzneistoff Doxazosinmesilat, abgeleitet von der Stickstoffbase Doxazosin.
Im Englischen gibt es zur Schreibweise nach INN-Nomenklatur („mesilate“) eine abweichende Variante („mesylate“), die der Schreibweise nach dem United States Adopted Name Council entspricht.[28]
Verwendung
BearbeitenMSA dient als Lösungsmittel und Katalysator für verschiedenste organische Reaktionen wie z. B. Alkylierungen, Veresterungen, Polymerisationen oder Heterocyclen-Synthesen.[29][30][31][32][33] Mittels Thionylchlorid kann sie zum reaktiven Methansulfonylchlorid umgesetzt werden, mit dem Hydroxygruppen in Methansulfonsäureester umgewandelt werden können – das Methansulfonat-Anion stellt im Rahmen von nucleophilen Substitutionen die deutlich bessere, da weniger reaktive Abgangsgruppe dar.[34] Als Bestandteil von Reinigern findet MSA zunehmend Verwendung, weil die Verbindung trotz großer Säurestärke (stärker als Phosphorsäure) deutlich ungefährlicher ist als klassische Reinigersäuren wie Phosphor-, Salz- und Schwefelsäure.[35] Die entstehenden Erdalkali-, Eisen- und Manganmethansulfonate sind sehr gut wasserlöslich. Da sich die Quecksilber-, Blei- und Silbermethansulfonate im Gegensatz zu den entsprechenden unlöslichen Salz- und Schwefelsäuresalzen ebenfalls sehr gut in Wasser lösen, können sie als Elektrolyten in methansulfonsauren Galvanisierbädern eingesetzt werden.[3][16] Einige basische Arzneistoffe werden als Methansulfonsäure-Salze eingesetzt, so z. B. Rasagilin.
Verbindungen
BearbeitenMethansulfonate lassen sich in vielen Fällen aus der Säure und dem Carbonat, Hydroxid oder Oxid des jeweiligen Metallkations gewinnen. Ebenfalls möglich ist eine Herstellung auf elektrolytischem Wege, bei der das zu oxidierende Metall in einem MSA-Bad anodisch geschaltet wird. Aus den Verbindungen darstellbar sind auch die Methansulfonate diverser stickstoffhaltiger Basen wie z. B. Ammoniak,[36] Methylamin[3] oder 1-Ethyl-3-methylimidazolium (EMIM, siehe 1-Ethyl-3-methylimidazoliumchlorid, EMIM[Cl]). Durch die Reaktion mit EMIM erhält man eine ionische Flüssigkeit.[37] Die Salze der MSA sind grundsätzlich sehr gut wasserlöslich, da die Ausbildung eines stabilen Ionengitters durch die Einwertigkeit des Anions und den unpolaren Methylrest erschwert wird. Letzterer ermöglicht es sowohl der Säure als auch den Salzen, sich zu einem gewissen Ausmaß ebenfalls in unpolaren Lösemitteln zu lösen. Die meisten Methansulfonate sind bis etwa 400 °C stabil, danach tritt eine thermische Zersetzung des organischen Methylrests ein. Die Salze sind somit temperaturbeständiger als die Säure selbst.[38][39][40][41][42][43][44]
Das Anion wurde bereits strukturchemisch untersucht, es besitzt annähernd C3v-Symmetrie.[45] Es ist weiterhin in der Lage, als Komplex-Ligand zu fungieren.[46] Die Einordnung in die spektrochemische Reihe erfolgt nach Cl− < F− ~ SO3Cl− ~ SO3F−< SO42− < CH3SO3− < H2O, in die nephelauxetische Reihe nach Cl− < CH3SO3− < SO42− < SO3Cl− ~ SO3F− ~ H2O < F−.[47] Die katalytischen Eigenschaften einiger Methansulfonate – u. a. als chloridfreie Lewis-Säuren – werden seit mehreren Jahren verstärkt untersucht; so erzielen bspw. Lanthanoid-Methansulfonate positive Effekte bei einigen Veresterungsreaktionen.[48][49]
Umweltchemie
BearbeitenMSA ist ein Indikator für die Menge der Schwefelemissionen ozeanischen Ursprungs, die in die Atmosphäre gelangen. Sie ist damit auch ein Indikator für die Säurehaltigkeit der Atmosphäre. Dort entsteht MSA als Zwischenprodukt des natürlichen Schwefelzyklus bei der photochemischen Umwandlung von Dimethylsulfid zu Sulfataerosolen.[50]
MSA ist nach der OECD Richtlinie 301 A biologisch leicht abbaubar, wobei Kohlendioxid und Sulfat als Abbauprodukte entstehen.[35]
Weblinks
BearbeitenSiehe auch
BearbeitenEinzelnachweise
Bearbeiten- ↑ Datenblatt Methansulfonsäure bei Merck, abgerufen am 18. Januar 2011.
- ↑ a b c d Methanesulfonic acid. In: The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 0-911910-00-X, S. 698.
- ↑ a b c d e f g h Lutropur – the friendly acid. BASF, abgerufen am 21. September 2017 (PDF; 707 kB).
- ↑ J. H. R. Clarke, L. A. Woodward, Trans. Faraday Soc. 1966, 62, 2226.
- ↑ A. K. Covington, R. Thompson, Journal of Solution Chemistry 1974, 3, 603-617.
- ↑ a b Eintrag zu Methansulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Eintrag zu Methanesulphonic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Methansulfonsäure 70 %, zur Synthese (PDF) bei Carl Roth, abgerufen am 30. Mai 2014.
- ↑ Patent US6060621: Process for the preparation of methanesulfonic acid. Angemeldet am 1. Oktober 1998, veröffentlicht am 9. Januar 2000, Anmelder: Grillo-Werke AG, Erfinder: I. Biertümpel, K. Driemel, J. van de Flierdt, D.M.M. Rohe.
- ↑ Patent US2493038: Reaction of methane with sulfur trioxide. Angemeldet am 31. Mai 1946, veröffentlicht am 3. Januar 1950, Anmelder: Houdry Process Corporation, Erfinder: Aristid V. Grosse, John C. Snyder.
- ↑ L. J. Lobree, A. T. Bell: K2S2O8-Initiated Sulfonation of Methane to Methanesulfonic Acid. In: Industrial & Engineering Chemistry Research. Band 40, Nr. 3, 2001, S. 736–742, doi:10.1021/ie000725b.
- ↑ a b Michael McCoy: German firm claims new route to methanesulfonic acid | June 27, 2016 Issue – Vol. 94 Issue 26 | Chemical & Engineering News. In: cen.acs.org. Abgerufen am 4. Juli 2016.
- ↑ Patent US20160289176A1: Process for preparing alkanesulfonic acids from sulfur trioxide and an alkane. Angemeldet am 13. November 2014, veröffentlicht am 6. Oktober 2016, Anmelder: Grillo Chemie GmbH, Erfinder: T. Ott, I. Biertümpel, K. Bunthoff, A. Richards.
- ↑ Patent US261907: Di(methanesulfonyl) peroxide and its preparation. Angemeldet am 5. Januar 1951, veröffentlicht am 25. November 1952, Anmelder: The Dow Chemical co., Erfinder: G.D. Jones, R.E. Friedrich.
- ↑ Patent US20160289181A1: Novel initiator for preparing alkanesulfonic acids from alkane and oleum. Angemeldet am 17. November 2014, veröffentlicht am 6. Oktober 2016, Anmelder: Grillo-Werke AG, Erfinder: T. Ott, I. Biertümpel.
- ↑ a b M. D. Gernon, M. Wu, T. Buszta, P. Janney, In: Green Chemistry 1999, 127–140.
- ↑ Patent EP1133470B1: Verfahren zur Herstellung von Alkansulfonsäuren. Angemeldet am 22. November 1999, veröffentlicht am 21. Mai 2003, Anmelder: BASF AG, Erfinder: Klaus Ebel, Matthias Eiermann, Christian Tragut.
- ↑ Patent EP1133472B1: Verfahren zur Herstellung von organischen Disulfiden. Angemeldet am 25. November 1999, veröffentlicht am 23. Februar 2005, Anmelder: BASF AG, Erfinder: Werner Hesse, Hans-Josef Sterzel, Christian Tragut.
- ↑ Jona Göbelbecker: BASF startet Methansulfonsäure-Anlage in Ludwigshafen. In: Chemietechnik. 6. Mai 2022, abgerufen am 4. Februar 2023.
- ↑ S. Brownstein, A. E. Stillman, J. Phys. Chem. 1959, 63, 2061–2062.
- ↑ R. C. Paul, K. K. Paul, K. C. Malhotra, J. Chem. Soc. (A) 1970, 2712–2715.
- ↑ R. A. Craig, A. G. Garrett, S. M. Newman, J. Am. Chem. Soc. 1950, 72, 163–166.
- ↑ a b c BASF SE, EMV 0101 e 2008, New applications involving methanesulfonic acid.
- ↑ R. Ch. Paul, V. P. Kapila, R. Kuma, S. K. Gupta, S. K. Sharma, Z. anorg. allg. Chem. 1980, 471, 203–207.
- ↑ J. Barr, R. J. Gillespie, R. C. Thompson, Inorg. Chem. 1964, 3, 1149.
- ↑ E. A. Robinson, J. A. Ciruna: The chlorosulfuric acid solvent system. Part I. Electrical conductivity, transport number, and density measurements on solutions of simple bases. In: Canadian Journal of Chemistry. 46 (10), 1968, S. 1719, doi:10.1139/v68-286.
- ↑ R. A. Robinson, R. H. Stokes, Electrolyte Solutions, Indian Edn., Academic Press, New York 1959.
- ↑ a b International Nonproprietary Names (INN) for pharmaceutical substances – Names for radicals, groups & others, WHO 2012.
- ↑ BASF SE, EVD 0106 e 2007, The ideal acid for chemical synthesis.
- ↑ L.-S. Tan, K. R. Srinivasan, S. J. Bai, R. J. Spry, Journal of Polymer Science A: Polymer Chemistry 1998, 26, 713–724.
- ↑ H. Jie, W. Meixiang, Journal of Polymer Science Part A Polymer Chemistry 1999, 37, 1277–1284.
- ↑ M. G. Zolotukhin, H. M. Colquhoun, L. G. Sestiaa, D. R. Rueda, D. Flot, Macromolecules 2003, 36, 4766-4771.
- ↑ S. Gazeau-Bureau, D. Delcroix, B. Martín-Vaca, D. Bourissou, C. Navarro, S. Magnet, Macromolecules 2008, 41, 3782-3784.
- ↑ K. Schwetlick, Organikum, 23. Auflage, Wiley-VCH, Weinheim 2009.
- ↑ a b BASF SE, EVD 0113 d 2005, Die „grüne“ Säure für Reiniger.
- ↑ C. H. Wei, Acta Cryst. 1986, C42, 1839–1842.
- ↑ M. O’Meara, A. Alemany, M. Maase, U. Vagt, I. Malkowsky, Metal Finishing 2009: Deposition of Aluminum Using Ionic Liquids ( vom 5. September 2015 im Internet Archive), aufgerufen am 17. September 2010.
- ↑ L. B. Zinner, An. Assoc. Bras. Quim. 1979, XXX, 27-32.
- ↑ M. S. Wickleder, Z. Anorg. Allg. Chem. 2001, 627, 1675–1681.
- ↑ M. de F. V. de Moura, J. do R. Matos, R. F. de Farias, Thermochimica Acta 2004, 414, 159–166.
- ↑ M. de F. V. de Moura, J. do R. Matos, R. F. de Farias, J. Serb. Chem. Soc. 2006, 71, 905–915.
- ↑ E. M. Aricó, L. B. Zinner, C. Apostolidis, E. Dornberger, B. Kanellakopulos, J. Rebizant, Journal of Alloys and Compounds 1997, 249, 111–115.
- ↑ E. M. Aricó, L. B. Zinner, C. Apostolidis, E. Dornberger, B. Kanellakopulos, J. Rebizant, Journal of Alloys and Compounds 2001, 323–324, 39–44.
- ↑ L. B. Zinner, An. Acad. brasil. Ciênc 1980, 52, 715-722.
- ↑ N. C. Johnson, J. T. Turk, W. E. Bull, H. G. Mayfield, Jr., Inorganica Chimica Acta 1977, 25, 235–239.
- ↑ I. Rozas, D. F. Weaver, J. Chem. Soc., Perkin Trans. 2 1996, 461–465.
- ↑ R. C. Paul, V. P. Kapila, N. Palta, S. K. Sharma, Indian Journal of Chemistry 1974, 12, 825–826.
- ↑ R. C. Paul, V. P. Kapila, S. K. Sharma, J. inorg. nucl. Chem. 1974, 36, 1933–1936.
- ↑ Patent CN101314563: A method for producing oleic pentaerythritol ester. Angemeldet am 6. Juni 2008, veröffentlicht am 3. Dezember 2008, Anmelder: Xiaohan Du, Erfinder: Xiaohan Du, Songhe Huang.
- ↑ Simon C. Baker, Don P. Kelly, J. Colin Murrell: Microbial degradation of methanesulphonic acid: a missing link in the biogeochemical sulphur cycle. In: Nature. Band 350, Nr. 6319, 18. April 1991, S. 627–628, doi:10.1038/350627a0 (PDF).

