Magnesiumnitrid
Magnesiumnitrid ist eine chemische Verbindung aus den Elementen Magnesium und Stickstoff. Es besitzt die Formel Mg3N2 und gehört zur Stoffgruppe der Nitride.
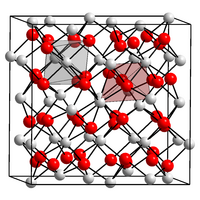
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ N3− _ Mg2+ | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumnitrid | |||||||||||||||
| Verhältnisformel | Mg3N2 | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,71 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte Bearbeiten
Magnesiumnitrid wurde im Jahr 1862 erstmals von den deutschen Chemikern Friedrich Briegleb und Johann Georg Anton Geuther hergestellt und beschrieben.[3][4]
Gewinnung und Darstellung Bearbeiten
Es entsteht als gelber Feststoff zum Beispiel beim Erhitzen von metallischem Magnesium auf ca. 300 °C unter Stickstoffatmosphäre.[5]
Diese Reaktion verläuft mit −462,8 kJ·mol−1 aus der festen Phase bzw. mit −479,6 kJ·mol−1 aus der flüssigen Phase stark exotherm.[6]
Ebenfalls möglich ist die Herstellung durch Reaktion von Magnesium und Ammoniak.[5]
Bei der Verbrennung von Magnesiummetall an Luft entsteht es neben Magnesiumoxid (MgO) und lässt dieses gelblich erscheinen.
Eigenschaften Bearbeiten
Magnesiumnitrid ist ein grünlichgelbes bis gelborange gefärbtes, lockeres Pulver. Es kristallisiert im kubischen Anti-Bixbyit Strukturtyp (a = 9,95 Å) und ist damit ein Typ-C Sesquioxid.[7][8] Mit Wasser hydrolysiert Magnesiumnitrid zu Magnesiumhydroxid und Ammoniak.[5]
Im historischen Serpek-Verfahren wurde diese Reaktion (neben der Hydrolyse von Aluminiumnitrid) zur Ammoniaksynthese eingesetzt (siehe Haber-Bosch-Verfahren).
Einzelnachweise Bearbeiten
- ↑ a b c d Datenblatt Magnesiumnitrid bei Alfa Aesar, abgerufen am 15. Dezember 2010 (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu Magnesiumnitrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ F. Briegleb, J. G. A. Geuther: Ueber das Stickstoffmagnesium und die Affinitäten des Stickgases zu Metallen in [[Ann. Chem. Pharm.]] 123 (1862) 228.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 93 pdf.
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 911.
- ↑ Yuan Chunmiao, Yu Lifu, Li Chang, Li Gang, Zhong Shengjun: Thermal analysis of magnesium reactions with nitrogen/oxygen gas mixtures in J. Hazard. Mat. 260 (2013) 707–714, doi:10.1016/j.jhazmat.2013.06.047.
- ↑ D. E. Partin, D. J. Williams, M. O'Keeffe: The Crystal Structures of Mg3N2and Zn3N2. In: Journal of Solid State Chemistry. Band 132, Nr. 1, 1. August 1997, S. 56–59, doi:10.1006/jssc.1997.7407.
- ↑ Linus Pauling, M. D. Shappell: 8. The Crystal Structure of Bixbyite and the C-Modification of the Sesquioxides. In: Zeitschrift für Kristallographie - Crystalline Materials. Band 75, Nr. 1, 1. Dezember 1930, S. 128–142, doi:10.1515/zkri-1930-0109.

