Indolacetaldoxim
Indolacetaldoxim ist ein von Tyrosin abgeleitetes Oxim, das als Intermediat im Stoffwechsel von Pflanzen vorkommt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
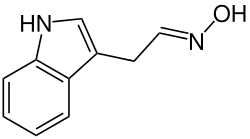
| |||||||||||||
| (E)-Form | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Indolacetaldoxim | ||||||||||||
| Summenformel | C10H10N2O | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 174,20 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
140–141 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Vorkommen und biologische Bedeutung Bearbeiten
Die Biosynthese von Indolacetaldoxim in Arabidopsis thaliana wurde untersucht, dort wird es durch ein Cytochrom-P450-Enzym aus Tyrosin gebildet.[3] Die Verbindung kommt in der Familie der Kreuzblütler vor, neben Arabidosis thaliana z. B. in Raps, Rüben und Braunem Senf.[4][5] In verschiedenen Pflanzen ist es wiederum biosynthetischer Vorläufer von Glucosinolaten (Glucobrassicin), Indolessigsäure, Indolacetonitril,[S 1] Camalexin, Brassinin und Brassilexin.[3][4][5][6][7][S 2] Bei verschiedenen pathogenen Pilzen, die Kreuzblütler befallen, wurde nachgewiesen, dass diese Indolacetaldoxim zu Indolessigsäure abbauen können.[5] In vielen Pflanzen aus anderen Familien, z. B. Tomate, Erbse, Mais, Reis und Tabak, konnte kein Indolacetaldoxim gefunden werden. Indolessigsäure ist eines der wichtigsten Pflanzenhormon bei Pflanzen allgemein, der biosynthetische Prozess über Indolacetaldoxim ist jedoch für die Kreuzblütler spezifisch und unterscheidet sich von den biosynthetischen Herstellungsprozessen in anderen Pflanzen.[4][8]
Herstellung Bearbeiten
Indolacetaldoxim kann durch Umsetzung von Indolacetaldehyd[S 3] mit Hydroxylaminhydrochlorid gewonnen werden.[9]
Einzelnachweise Bearbeiten
- ↑ a b Dictionary of Food Compounds with CD-ROM. CRC Press, ISBN 978-1-4200-6845-0, S. 744 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Michael Dalgaard Mikkelsen, Carsten Hørslev Hansen, Ute Wittstock, Barbara Ann Halkier: Cytochrome P450 CYP79B2 from Arabidopsis Catalyzes the Conversion of Tryptophan to Indole-3-acetaldoxime, a Precursor of Indole Glucosinolates and Indole-3-acetic Acid. In: Journal of Biological Chemistry. Band 275, Nr. 43, Oktober 2000, S. 33712–33717, doi:10.1074/jbc.M001667200.
- ↑ a b c Y. Mano, K. Nemoto: The pathway of auxin biosynthesis in plants. In: Journal of Experimental Botany. Band 63, Nr. 8, 1. Mai 2012, S. 2853–2872, doi:10.1093/jxb/ers091.
- ↑ a b c M.Soledade C Pedras, Sabine Montaut: Probing crucial metabolic pathways in fungal pathogens of crucifers: biotransformation of indole-3-acetaldoxime, 4-hydroxyphenylacetaldoxime, and their metabolites. In: Bioorganic & Medicinal Chemistry. Band 11, Nr. 14, Juli 2003, S. 3115–3120, doi:10.1016/S0968-0896(03)00241-4.
- ↑ Erich Glawischnig, Bjarne Gram Hansen, Carl Erik Olsen, Barbara Ann Halkier: Camalexin is synthesized from indole-3-acetaldoxime, a key branching point between primary and secondary metabolism in Arabidopsis. In: Proceedings of the National Academy of Sciences. Band 101, Nr. 21, 25. Mai 2004, S. 8245–8250, doi:10.1073/pnas.0305876101, PMID 15148388, PMC 419588 (freier Volltext).
- ↑ Majse Nafisi, Sameer Goregaoker, Christopher J. Botanga, Erich Glawischnig, Carl E. Olsen, Barbara A. Halkier, Jane Glazebrook: Arabidopsis Cytochrome P450 Monooxygenase 71A13 Catalyzes the Conversion of Indole-3-Acetaldoxime in Camalexin Synthesis. In: The Plant Cell. Band 19, Nr. 6, 31. Juli 2007, S. 2039–2052, doi:10.1105/tpc.107.051383, PMID 17573535, PMC 1955726 (freier Volltext).
- ↑ Satoko Sugawara, Shojiro Hishiyama, Yusuke Jikumaru, Atsushi Hanada, Takeshi Nishimura, Tomokazu Koshiba, Yunde Zhao, Yuji Kamiya, Hiroyuki Kasahara: Biochemical analyses of indole-3-acetaldoxime-dependent auxin biosynthesis in Arabidopsis. In: Proceedings of the National Academy of Sciences. Band 106, Nr. 13, 31. März 2009, S. 5430–5435, doi:10.1073/pnas.0811226106, PMID 19279202, PMC 2664063 (freier Volltext).
- ↑ J. N. Coker, W. L. Kohlhase, T. F. Martens, A. O. Rogers, G. G. Allan: A General Route to Hydantoins. In: The Journal of Organic Chemistry. Band 27, Nr. 9, September 1962, S. 3201–3204, doi:10.1021/jo01056a051.
Anmerkungen Bearbeiten
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Indolacetonitril: CAS-Nummer: 771-51-7, EG-Nummer: 212-232-1, ECHA-InfoCard: 100.011.120, GESTIS-Stoffdatenbank: 35880, PubChem: 351795, ChemSpider: 312357, Wikidata: Q27102461.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Brassilexin: CAS-Nummer: 119752-76-0, PubChem: 135413564, Wikidata: Q105179461.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Indolacetaldehyd: CAS-Nummer: 2591-98-2, PubChem: 800, ChemSpider: 778, Wikidata: Q27102813.