Hexahelicen
Hexahelicen ist ein polycyclischer aromatischer Kohlenwasserstoff aus der Gruppe der Helicene.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
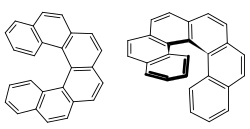
| ||||||||||
| (+)-Hexahelicen | ||||||||||
| Allgemeines | ||||||||||
| Name | Hexahelicen | |||||||||
| Summenformel | C26H16 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 328,4 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Geschichte Bearbeiten
Zum ersten Mal wurde Hexahelicen 1956 von Melvin und Lednicer in einer zehnstufigen Synthese ausgehend von Naphthalin-1-carbaldehyd synthetisiert. Damals wurden auch schon die Chiralität der Verbindung und ihre Racematspaltung beschrieben.[4][5]
Synthese Bearbeiten
Hexahelicen sowie verschiedene substituierte Derivate können über Biphenyl-Naphtalin-Intermediate synthetisiert werden. Zunächst werden durch Sonogashira-Kupplungen und Suzuki-Kupplungen zwei Vorläufermoleküle hergestellt. Diese werden durch eine mit Pd(PPh3)4 katalysierte Suzuki-Kupplung verbunden und dann durch Platin(II)-chlorid zu Hexahelicen cyclisiert.[6]
Die Synthese gelingt auch ausgehend von 2,7-Dimethylnaphthalin in zwei Stufen mit einer Gesamtausbeute von 53 %. Dabei wird zunächst durch eine Siegrist-Kondensation mit Benzylidenananilin 2,7-Distyrylnaphtalin gebildet und dieses dann photocyclisiert. Da hierdurch ein teilweise gesättigtes Produkt entsteht wird für die Oxidation zu Hexahelicen elementares Iod zugesetzt.[7]
Eine teilweise enantioselektive Synthese von Hexahelicen ist durch eine Cyclisierung mittels zirkular polarisiertem Licht möglich. Geeignete Edukte sind 1-(2-Naphthyl)-2-(3-phenanthryl)ethylen (25 % Ausbeute) oder 1-(2-Benzo[c]phenanthryl)-2-phenylethylen (85 % Ausbeute). Als Intermediat entstehen dabei teilweise gesättigte Verbindungen, die aber durch Zusatz von elementarem Iod zum Reaktionsgemisch direkt in Hexahelicen überführt werden können.[8]
Resolution des Racemats Bearbeiten
Racemisches Hexahelicen kann in seine beiden Enantiomere aufgetrennt werden, indem eines mittels enantiomerenreiner 2-(2,4,5,7-Tetranitrofluoriden-9-ylaminooxy)propansäure selektiv kristallisiert wird.[4][9]
Eigenschaften Bearbeiten
Hexahelicen existiert in Form zweier Enantiomere. (−)-Hexahelicen entspricht einer linksdrehenden Helix und ist auch optisch linksdrehend. Demgegenüber entspricht (+)-Hexahelicen einer rechtsdrehenden Helix und ist optisch rechtsdrehend.[5] Bei höheren Temperaturen racemisiert enantiomerenreines Hexahelicen. Die Halbwertszeit wurde bei 187,6 °C zu 187 Minuten bestimmt, bei 205,2 °C zu 48 Minuten und bei 221,4 °C zu 13,4 Minuten.[10]
Racemisches Hexahelicen kristallisiert in der chiralen Raumgruppe P212121. Dabei liegt eine Schichtstruktur vor, bei der sich abwechselnde Schichten jeweils nur ein Enantiomer enthalten.[2][11] Hexahelicen weist Fluoreszenz auf.[12]
Hexahelicen bildet einen Komplex mit Silber(I), der sowohl in der Festphase (als Perchlorat) existiert als auch in der Gasphase.[13]
Toxizität Bearbeiten
Die Umwelttoxizität von Hexahelicen wurde an verschiedenen Wasser- und Bodenorganismen untersucht. Bei den Wasserorganismen (Daphnia magna, Desmodesmus subspicatus und Vibrio fisheri) wurden keine relevanten toxikologischen Effekte detektiert. Für die Bodenorganismen Enchytraeus crypticus (Familie Enchytraeidae) und Folsomia candida war es hingegen giftig.[14]
Verwendung Bearbeiten
Enantiomerenreine Helicene eignen sich als chirale Auxiliare.[15] Hexahelicen kann konkret für die enantioselektive Addition von Diisopropylzink an 2-(2-tert-Butylethinyl)pyrimidin-5-carbaldehyd verwendet werden.[16]
Einzelnachweise Bearbeiten
- ↑ a b Eintrag zu (±)-Hexahelicene bei Toronto Research Chemicals, abgerufen am 17. August 2023 (PDF).
- ↑ a b c Bernard S. Green, Marcel Knossow: Lamellar Twinning Explains the Nearly Racemic Composition of Chiral, Single Crystals of Hexahelicene. In: Science. Band 214, Nr. 4522, 13. November 1981, S. 795–797, doi:10.1126/science.214.4522.795.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Melvin S. Newman, Daniel Lednicer: The Synthesis and Resolution of Hexahelicene 1. In: Journal of the American Chemical Society. Band 78, Nr. 18, September 1956, S. 4765–4770, doi:10.1021/ja01599a060.
- ↑ a b David A. Lightner, Daniel T. Hefelfinger, Thomas W. Powers, Gerard W. Frank, Kenneth N. Trueblood: Hexahelicene. Absolute configuration. In: Journal of the American Chemical Society. Band 94, Nr. 10, Mai 1972, S. 3492–3497, doi:10.1021/ja00765a041.
- ↑ Jan Storch, Jan Sýkora, Jan Čermák, Jindřich Karban, Ivana Císařová, Aleš Růžička: Synthesis of Hexahelicene and 1-Methoxyhexahelicene via Cycloisomerization of Biphenylyl-Naphthalene Derivatives. In: The Journal of Organic Chemistry. Band 74, Nr. 8, 17. April 2009, S. 3090–3093, doi:10.1021/jo900077j.
- ↑ R. H. Martin, Marie-Jeanne Marchant, M. Baes: Rapid Syntheses of Hexa and Heptahelicene. In: Helvetica Chimica Acta. Band 54, Nr. 1, 1971, S. 358–360, doi:10.1002/hlca.19710540140.
- ↑ Henri Kagan, A. Moradpour, J. F. Nicoud, Gilbert Balavoine, G. Tsoucaris: Photochemistry with circularly polarized light. Synthesis of optically active hexahelicene. In: Journal of the American Chemical Society. Band 93, Nr. 9, Mai 1971, S. 2353–2354, doi:10.1021/ja00738a061.
- ↑ Melvin S. Newman, Wilson B. Lutz, Daniel Lednicer: A NEW REAGENT FOR RESOLUTION BY COMPLEX FORMATION; THE RESOLUTION OF PHENANTHRO-[3,4-c]PHENANTHRENE 1. In: Journal of the American Chemical Society. Band 77, Nr. 12, Juni 1955, S. 3420–3421, doi:10.1021/ja01617a097.
- ↑ R.H. Martin, Marie-Jeanne Marchant: Thermal racemisation of [6], [7], [8] and [9] helicene. In: Tetrahedron Letters. Band 13, Nr. 35, Januar 1972, S. 3707–3708, doi:10.1016/S0040-4039(01)94141-3.
- ↑ Subramanium Ramdas, John M. Thomas, M. E. Jordan, Craig J. Eckhardt: Enantiomeric intergrowth in hexahelicenes. In: The Journal of Physical Chemistry. Band 85, Nr. 16, August 1981, S. 2421–2425, doi:10.1021/j150616a024.
- ↑ E. Vander Donckt, J. Nasielski, J.R. Greenleaf, J.B. Birks: Fluorescence of the helicenes. In: Chemical Physics Letters. Band 2, Nr. 6, Oktober 1968, S. 409–410, doi:10.1016/0009-2614(68)80041-7.
- ↑ Blanka Klepetářová, Emanuel Makrlík, Jana Jaklová Dytrtová, Stanislav Böhm, Petr Vaňura, Jan Storch: [6]Helicene as a novel molecular tweezer for the univalent silver cation: Experimental and theoretical study. In: Journal of Molecular Structure. Band 1097, Oktober 2015, S. 124–128, doi:10.1016/j.molstruc.2015.04.022.
- ↑ Sovova, Tereza, et al. "Preliminary Soil and Aquatic Ecotoxicity Evaluation of [6] Helicene." Polish Journal of Environmental Studies 24.5 (2015).
- ↑ Yun Shen, Chuan-Feng Chen: Helicenes: Synthesis and Applications. In: Chemical Reviews. Band 112, Nr. 3, 14. März 2012, S. 1463–1535, doi:10.1021/cr200087r.
- ↑ Itaru Sato, Ryutaro Yamashima, Kousuke Kadowaki, Jun Yamamoto, Takanori Shibata, Kenso Soai: Asymmetric Induction by Helical Hydrocarbons: [6]- and [5]Helicenes. In: Angewandte Chemie. Band 113, Nr. 6, 16. März 2001, S. 1130–1132, doi:10.1002/1521-3757(20010316)113:6<1130::AID-ANGE11300>3.0.CO;2-6.