Etretinat
Etretinat ist eine chemische Verbindung aus der Gruppe der Retinoide und das Trimethylmethoxyphenyl-Analogon des Ethylesters der all-trans-Retinsäure, dem Ethylretinoat.[S 1]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
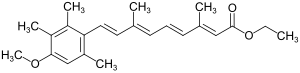
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Etretinat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C23H30O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 354,49 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Gewinnung und Darstellung
BearbeitenEtretinat kann durch eine mehrstufige Reaktion ausgehend von 2,3,5-Trimethylphenol 1 synthetisiert werden.
Nach der Methylierung von 1 zum 2,3,5-Trimethylanisol[S 2] 2 wird dieses in einer Friedel-Crafts-Alkylierung in Gegenwart von Trifluorboran / Diethylether mit 3-Methyl-1-penten-4-in-3-ol[S 3] 3 umgesetzt und man erhält neben dem ortho-Isomeren das terminale Alkin 4. Dieses wird mit Butyllithium in TFH deprotoniert und mit dem Aldehyd 5 zu dem Propargylalkohol 6 umgesetzt. Die selektive Hydrierung der Dreifachbindung mit einem Lindlar-Katalysator führt zu dem Trien 7, das anschließend in einer durch Toluolsulfonsäure katalysierten Dehydratisierung zu einem Isomerengemisch 8 überführt wird. Die Behandlung des Isomerengemischs mit Palladium(II)-nitrat in Acetonitril führt zu einem Gemisch, das nach HPLC zu 65 % Etretinat enthält.[3]
Eigenschaften
BearbeitenEtretinat ist ein weißes bis gelbes, kristallines Pulver, das praktisch unlöslich in Wasser ist.[1] Es wird im Körper hauptsächlich zu Acitretin metabolisiert.[4] Alkoholkonsum kann dazu führen, dass Acitretin wieder zu Etretinat verstoffwechselt wird.[5] Aufgrund seiner konjugierten Tetraenstruktur kann Etretinat bei Exposition leicht Photoisomerisierungsreaktionen eingehen, wenn es, insbesondere in Lösung, Licht ausgesetzt wird.[2]
Verwendung
BearbeitenEtretinat ist ein Retinoid der zweiten Generation, das früher systemisch als peroral anwendbares Vitamin-A-Derivat zur Behandlung der Psoriasis und anderen Dyskeratosen eingesetzt, dann aber aufgrund von Teratogenität vom Markt genommen wurde. Etretinat verändert die cAMP-Signalübertragung, die bei Psoriasis gestört sein kann.[6][7][8][9] Bei der Anwendung ist besonders zu beachten, dass Etretinat teilweise extrem lange im Körper gespeichert und im Fettgewebe abgelagert wird. Bei langzeitiger Anwendung wurden Halbwertszeiten von mehr als 100 Tagen gemessen. Eine Schwangerschaft kann erst 2 Jahre nach Beendigung der Therapie mit der Verbindung als risikolos angesehen werden.[5][10]
Die Verbindung wurde in den 1970er Jahren entwickelt[11] und unter dem Namen Tegison von Roche Laboratories (einer Tochterfirma von Hoffmann-La Roche) im Oktober 1986 für die Behandlung von schwerer, rezidivierender Psoriasis zugelassen.[12]
Regulierung
BearbeitenÜber den Safe Drinking Water and Toxic Enforcement Act of 1986 besteht in Kalifornien seit 1. Juli 1987 eine Kennzeichnungspflicht für Produkte, die Etretinat enthalten.[13]
Anmerkungen
Bearbeiten- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Ethylretinoat: CAS-Nummer: 3899-20-5, PubChem: 6505370, ChemSpider: 5005364, Wikidata: Q83064924.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,5-Trimethylanisol: CAS-Nummer: 20469-61-8, EG-Nummer: 243-843-1, ECHA-InfoCard: 100.039.842, PubChem: 88555, ChemSpider: 79900, Wikidata: Q72513911.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Methyl-1-penten-4-in-3-ol: CAS-Nummer: 3230-69-1, EG-Nummer: 221-770-6, ECHA-InfoCard: 100.019.791, PubChem: 97815, ChemSpider: 88290, Wikidata: Q72494464.
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h Eintrag zu Etretinat, >98,0% bei TCI Europe, abgerufen am 13. Januar 2024.
- ↑ a b IARC: Handbook Etretinate, abgerufen am 13. Januar 2024.
- ↑ Milan Soukup, Emil Broger, Erich Widmer: Neue Zugänge zu einigen aromatischen Retinoiden. In: Helvetica Chimica Acta. Band 72, Nr. 2, 1989, S. 370–376, doi:10.1002/hlca.19890720224.
- ↑ Fortschritte der praktischen Dermatologie und Venerologie. Springer Berlin Heidelberg, ISBN 978-3-642-78163-6, S. 283 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Risikoinformationen – Acitretin und Teratogenität: Einhaltung der Sicherheitsmaßnahmen bei Frauen im gebärfähigen Alter, BfArM, abgerufen am 13. Januar 2024.
- ↑ Biomol: Etretinate, CAS 54350-48-0, abgerufen am 13. Januar 2024.
- ↑ Alan Ward, R. N. Brogden, R. C. Heel, T. M. Speight, G. S. Avery: Etretinate. In: Drugs. Band 26, Nr. 1, 1983, S. 9–43, doi:10.2165/00003495-198326010-00002.
- ↑ Dermatologische Onkologie. Springer Berlin Heidelberg, ISBN 978-3-642-60622-9, S. 113 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ R. Happle, H. Traupe, Y. Bounameaux, T. Fisch: Teratogene Wirkung von Etretinat beim Menschen. In: DMW - Deutsche Medizinische Wochenschrift. Band 109, Nr. 39, 1984, S. 1476–1480, doi:10.1055/s-2008-1069397.
- ↑ F. von Bruchhausen, G. Dannhardt, S. Ebel, A. W. Frahm, E. Hackenthal, R. Hansel, u. Holzgrabe, K. Keller, E. Niirnberg, H. Rimpler, G. Schneider, P. Surmann, H. U. Wolf, G. Wurm: Hagers Handbuch der Pharmazeutischen Praxis. Springer Berlin Heidelberg, ISBN 978-3-642-57994-3, S. 158 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Advances in Drug Research. Elsevier Science, ISBN 978-0-08-052628-7, S. 39 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Morbidity and Mortality Weekly Report. U.S. Department of Health, Education, and Welfare, Public Health Service, Center for Disease Control, S. 177 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Etretinate. OEHHA, 1. Juli 1987, abgerufen am 14. Januar 2024 (englisch).