Diethylaluminiumcyanid
Diethylaluminiumcyanid ist eine aluminiumorganische Verbindung, die eine Cyanogruppe aufweist. Es wird auch als Nagata-Reagenz bezeichnet und wird in Hydrocyanierungen, unter anderem in der Nagata-Reaktion, eingesetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
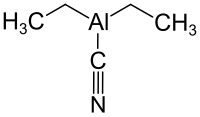
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diethylaluminiumcyanid | ||||||||||||||||||
| Summenformel | C5H10AlN | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 111,12 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Herstellung
BearbeitenDiethylaluminiumcyanid kann durch längere Erhitzung von Diethylaluminiumchlorid mit Natriumcyanid in Benzol unter Stickstoffatmosphäre hergestellt werden.[2]
Eigenschaften
BearbeitenIm Gegensatz zu vielen anderen Alkylaluminiumverbindungen ist Diethylaluminiumcyanid nicht pyrophor. Es ist löslich in Benzol, Toluol und Diisopropylether.[3]
Reaktionen
BearbeitenDiethylaluminiumcyanid wird insbesondere zur Hydrocyanierung von Enonen eingesetzt, wobei eine 1,4-Addition stattfindet. Die Reaktion erfolgt durch einfaches Vermischen. Das Enon wird in einem aprotischen Lösungsmittel vorgelegt und das Diethylaluminiumcyanid in Lösung zugegeben. Anschließend wird das Reaktionsgemisch bei Raumtemperatur oder unter weiterer Kühlung stehen gelassen. Als Lösungsmittel eignen sich beispielsweise Benzol, Toluol, Dichlormethan, Diethylether, Diisopropylether, Dioxan oder Tetrahydrofuran (THF). Die Reaktion verläuft schneller, je weniger basisch das Lösungsmittel ist. So ist die Reaktionsgeschwindigkeit in Benzol deutlich größer als in THF.[3] Nach dem Autor dieser ursprünglichen Publikation, Wataru Nagata, wird Diethylaluminiumcyanid auch als Nagata-Reagenz und die Umsetzung als Nagata-Reaktion bezeichnet.[4]
Diethylaluminiumcyanid eignet sich daneben auch zur Umsetzung von Aldehyden und Ketonen zu Cyanhydrinen und wird vor allem eingesetzt, wenn das Edukt wenig reaktiv ist.[5]
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R. Ehrlich, A.R. Young: The chemistry of alane—X. Dimethyl- and diethylaluminum cyanide. In: Journal of Inorganic and Nuclear Chemistry. Band 28, Nr. 2, Februar 1966, S. 674–676, doi:10.1016/0022-1902(66)80356-1.
- ↑ a b W. Nagata, M. Yoshioka, S. Hirai: Hydrocyanation. IV. New hydrocyanation methods using hydrogen cyanide and an alkylaluminum, and an alkylaluminum cyanide. In: Journal of the American Chemical Society. Band 94, Nr. 13, Juni 1972, S. 4635–4643, doi:10.1021/ja00768a037.
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. 1. Auflage. Wiley, 2010, ISBN 978-0-471-70450-8, doi:10.1002/9780470638859.conrr451.
- ↑ Robert J. H. Gregory: Cyanohydrins in Nature and the Laboratory: Biology, Preparations, and Synthetic Applications. In: Chemical Reviews. Band 99, Nr. 12, 8. Dezember 1999, S. 3649–3682, doi:10.1021/cr9902906.