Apalutamid
Apalutamid (im Englischen Apalutamide) ist ein orales, nicht-steroidales Antiandrogen (NSAA), welches zur Behandlung von Prostatakarzinomen eingesetzt wird.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
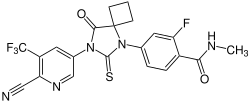
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Apalutamid[1] | |||||||||||||||||||||
| Andere Namen |
4-{7-[6-Cyan-5-(trifluormethyl)pyridin-3-yl]-8-oxo-6-sulfanyliden-5,7-diazaspiro[3.4]octan-5-yl}-2-fluor-N-methylbenzamid | |||||||||||||||||||||
| Summenformel | C21H15F4N5O2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes, leicht gelbliches Pulver[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
nicht steroidale Antiandrogene | |||||||||||||||||||||
| Wirkmechanismus |
Inhibition des Androgenrezeptor-Signalweges | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 477,44 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Entwicklung und Zulassung
BearbeitenProstatakarzinome entwickeln unter der Therapie mit Androgendeprivation (Entzug von Androgenen, zum Beispiel durch Hodenentfernung oder GnRH-Analoga) eine Überexpression von Androgen-Rezeptoren und werden dadurch therapieresistent. Daher wurde nach Medikamenten gesucht, die eine intensivere Bindung an Androgen-Rezeptoren aufweisen.[5] Im Tiermodell wurde das Pharmakon ARN-509 (späterer Name Apalutamid) als besonders aussichtsreich gefunden und in klinischen Studien erprobt. Am 14. Februar 2018 wurde Apalutamid aufgrund der SPARTAN-Studie[6] von der amerikanischen Food and Drug Administration (FDA) für die Behandlung von Patienten mit kastrationsresistentem, nicht metastasiertem Prostatakarzinom zugelassen.
Am 19. September 2019 erfolgte aufgrund der TITAN-Studie[7] die FDA-Zulassung von Apalutamid für Patienten mit Androgen-sensitivem, metastasierten Prostatakarzinom.[8] Am 19. März 2019 hat auch die Europäische Kommission Apalutamid für beide Indikationen zugelassen.[4]
Indikation
BearbeitenDie Leitlinie Prostatakarzinom empfiehlt die Anwendung von Apalutamid beim Prostatakarzinom mit dem höchsten Empfehlungsgrad A in zwei Situationen:
- Patienten in gutem Allgemeinzustand (ECOG-Score 0-1) mit metastasiertem (M1), hormonsensitiven, Prostatakarzinom (mHSPC) zusätzlich zu einer Androgendeprivation.[9] Hormonsensitiv heißt in diesem Fall, dass die Tumoren auf eine Androgendeprivation, also einen Entzug von Androgenen ansprechen. Diese Patienten konnte man bisher schon gut mit einer Androgendeprivationstherapie (ADT) behandeln, zum Beispiel durch die Entfernung der Hoden (Orchiektomie) oder die Injektion von GnRH-Analoga. In der Kombination mit Apalutamid ist das Therapieergebnis jedoch besser. Die Apalutamid-Behandlung soll innerhalb von drei Monaten nach Beginn der ADT einsetzen.
- Kastrationsresistente Prostatakarzinome reagieren nicht auf eine ADT durch Orchiektomie oder GnRH-Analoga und haben eine schlechte Prognose mit einem hohen Risiko einer Metastasierung. Die Leitlinie empfiehlt bei Patienten mit nicht-metastasiertem Prostatakarzinom (nmCRPC) und einem Risiko der Metastasierung innerhalb der nächsten 10 Monaten zusätzlich zur ADT Apalutamid oder ein anderes innovatives Präparat wie Darolutamid oder Enzalutamid zu geben.
Nebenwirkungen
BearbeitenUnter der Einnahme von Apalutamid kam es zu kardiovaskulären Ereignissen, zum Teil mit Todesfolge. In den Zulassungsstudie SPARTAN and TITAN starben 0,5 % mit Apalutamid und 0,2 % ohne an koronaren Herzerkrankungen. In der SPARTAN-Studie wurden unter Apalutamid mehr Knochenbrüche (12 %) beobachtet als ohne (7 %).
Bei der Einnahme können ferner Müdigkeit, Übelkeit, Bauchschmerzen, Durchfall, Hypertonie, Hautausschläge und eine Hypothyreose auftreten. Selten werden Krampfanfälle ausgelöst.[2]
Pharmakologie
BearbeitenApalutamid wird von der Firma Janssen-Cilag unter dem Handelsnamen Erleada in zwei unterschiedlichen Packungsgrößen mit Filmtabletten zu je 60 mg Apalutamid vertrieben.[10] Die übliche Tagesdosis beträgt 4 Tabletten pro Tag.[11] Diese Dosierung von 240 mg pro Tag wurde auch in den Zulassungsstudien TITAN[7] und SPARTAN[6] verwendet. Bei Nebenwirkungen dritten Grades wird eine Unterbrechung empfohlen, bis die Nebenwirkungen auf Grad eins abgeklungen sind. Dann sollte mit 180 mg oder 120 mg Tagesdosis fortgesetzt werden.[2]
Die Bioverfügbarkeit beträgt 100 %. Im Mittel ist zwei Stunden nach Einnahme der höchste Plasmaspiegel erreicht. Die Plasmaproteinbindung beträgt 95 %.
Apalutamid bindet direkt an die „Ligand-binding-Domain“ des Androgenrezeptors und verhindert eine Androgen-Rezeptor-Translokation in den Zellkern, die DNA-Bindung und damit alle Androgen-Rezeptor-abhängigen Transkriptionen.[12]
TITAN-Trial
BearbeitenAuf Basis der Ergebnisse aus dieser Studie erfolgte die Zulassung von Apalutamid beim metastasierten, Androgen-sensitiven Prostatakarzinom. Die Bezeichnung TITAN steht für „The Targeted Investigational Treatment Analysis of Novel Anti-androgen“ (ClinicalTrials-Nummer: NCT02489318).[13] In einer randomisierten, doppeltblinden, multizentrischen Phase-III-Studie wurden 525 Patienten mit metastasiertem Prostata-Karzinom mit Apalutamid und ADT behandelt, weitere 527 erhielten ein Placebo und eine ADT. Nach einer medianen Nachbeobachtungszeit von 22,7 Monaten lebten 68,2 % der Apalutamid-Patienten ohne Progress, in der Placebo-Gruppe nur 47,5 % (signifikant, p < 0,001). Auch das Gesamtüberleben war mit 82,4 % in der Apalutamid-Gruppe signifikant höher als in der Placebogruppe (73,5 %; p < 0,005).[7] Die Patienten hatten einen ECOG-Score von 0 oder 1. Viszerale Metastasen (Organbefall) hatten 128 der 1.042 Patienten. Eine Docetaxel-Chemotherapie ging bei 10,7 % der Patienten voraus.
SPARTAN-Trial
BearbeitenDiese Studie war die Datenbasis für die Zulassung von Apalutamid für Patienten mit kastationsresistentem Prostatakarzinom und einer kurzen PSA-Verdoppelungszeit als Zeichen der besonderen Bösartigkeit. Die Bezeichnung SPARTAN steht für „Selective Prostate Androgen Receptor Targeting with ARN-509“ (ClinicalTrials-Nummer: NCT01946204[14]). In einer multizentrischen, randomisierten Phase-III-Studie wurden 1207 bisher metastasenfreie Patienten mit Prostatakarzinom, die trotz Androgendeprivatation einen PSA-Anstieg mit einer Verdoppelungszeit von 10 Monaten oder weniger hatten, in eine Apalutamid-Gruppe (806 Patienten) und eine Placebo-Gruppe (401 Patienten) randomisiert. Zum Zeitpunkt der Auswertung war das metastasenfreie Überleben in der Apalutamid-Gruppe 40,5 Monate, in der Placebogruppe 16,2 Monate (hochsignifikant, p < 0,001). In beiden Gruppe wurde die ADT in gleicher Form fortgesetzt.[6] In einer späteren Auswertung nach Median 52 Monaten Nachbeobachtungszeit war auch die mittlere Gesamtüberlebenszeit unter Apalutamid mit 73,9 Monaten signifikant länger als mit Placebo (59,9 %).[15]
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 75, World Health Organisation (WHO), 9. März 2016.
- ↑ a b c d e Highlights of prescribing information. Janssen Pharmaceutical Companies, September 2019, abgerufen am 27. Februar 2022 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Erleada (Apalutamid) Übersicht über Erleada und warum es in der EU zugelassen ist. (PDF) Europäische Arzneimittelagentur, 2020, abgerufen am 28. Februar 2022.
- ↑ Chris Tran, Samedy Ouk, Nicola J. Clegg, Yu Chen, Philip A. Watson: Development of a Second-Generation Antiandrogen for Treatment of Advanced Prostate Cancer. In: Science. Band 324, Nr. 5928, 8. Mai 2009, doi:10.1126/science.1168175, PMID 19359544, PMC 2981508 (freier Volltext).
- ↑ a b c Matthew R. Smith, Fred Saad, Simon Chowdhury, Stéphane Oudard, Boris A. Hadaschik: Apalutamide Treatment and Metastasis-free Survival in Prostate Cancer. In: New England Journal of Medicine. Band 378, Nr. 15, 12. April 2018, S. 1408–1418, doi:10.1056/NEJMoa1715546.
- ↑ a b c Kim N. Chi, Neeraj Agarwal, Anders Bjartell, Byung Ha Chung, Andrea J. Pereira de Santana Gomes: Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. In: New England Journal of Medicine. Band 381, Nr. 1, 4. Juli 2019, S. 13–24, doi:10.1056/NEJMoa1903307.
- ↑ FDA approves apalutamide for metastatic castration-sensitive prostate cancer. FDA, 18. September 2019, abgerufen am 27. Februar 2022 (englisch).
- ↑ S3-Leitlinie Prostatakarzinom, Langversion 6.2, 2021, AWMF Registernummer: 043/022OL. (PDF) Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF), Oktober 2021, abgerufen am 22. Februar 2022.
- ↑ Elke Schlüssel: Neueinführung Erleada (Apalutamid). 30. Januar 2019, abgerufen am 21. Februar 2022.
- ↑ Gebrauchsinformation: Information für Anwender Erleada® 60 mg Filmtabletten, Apalutamid. Janssen ‑ Cilag GmbH, Februar 2021, abgerufen am 21. Februar 2022.
- ↑ Nicola J. Clegg, John Wongvipat, James D. Joseph, Chris Tran, Samedy Ouk: ARN-509: A Novel Antiandrogen for Prostate Cancer Treatment. In: Cancer Research. Band 72, Nr. 6, 15. März 2012, S. 1494–1503, doi:10.1158/0008-5472.CAN-11-3948, PMID 22266222, PMC 3306502 (freier Volltext) – (aacrjournals.org [abgerufen am 27. Februar 2022]).
- ↑ A Study of Apalutamide (JNJ-56021927, ARN-509) Plus Androgen Deprivation Therapy (ADT) Versus ADT in Participants With mHSPC. ClinicalTrial.gov, Februar 2022, abgerufen am 27. Februar 2022 (englisch).
- ↑ Has Results A Study of Apalutamide (ARN-509) in Men With Non-Metastatic Castration-Resistant Prostate Cancer. Clinicaltrials.gov, 25. Februar 2022, abgerufen am 27. Februar 2022 (englisch).
- ↑ Matthew R. Smith, Fred Saad, Simon Chowdhury, Stéphane Oudard, Boris A. Hadaschik: Apalutamide and Overall Survival in Prostate Cancer. In: European Urology. Band 79, Nr. 1, Januar 2021, S. 150–158, doi:10.1016/j.eururo.2020.08.011.
Anmerkungen
Bearbeiten