Anamorelin
Anamorelin ist ein Arzneistoff zur oralen Behandlung von Appetitlosigkeit (Anorexie) und Gewichtsverlust (Kachexie) in Folge bestimmter Krebserkrankungen. Im Januar 2021 wurde er in Japan unter dem Namen Adlumiz (Ono Pharmaceutical) zugelassen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
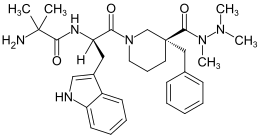
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Anamorelin[1] | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C31H42N6O3 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 546,70 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| pKS-Wert |
7,79[3] | |||||||||||||||
| Löslichkeit |
gering löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Eigenschaften
BearbeitenAnamorelin ist eine niedermolekulare Verbindung, die an ihren zwei chiralen Zentren jeweils in der R-Konfiguration vorliegt.
Pharmazeutisch eingesetzt wird der Wirkstoff als Anamorelinhydrochlorid,[4] einem (fast) weißen hygroskopischen Pulver, das leicht löslich in Wasser, Methanol und Ethanol, wenig löslich in Acetonitril und praktisch unlöslich in Ethylacetat, Essigsäureisopropylester und n-Heptan ist.[3]
Wirkungsmechanismus
BearbeitenDas nicht-peptidische Anamorelin ahmt die Wirkung des 1999 entdeckten Hormons Ghrelin nach, das vom Gastrointestinaltrakt freigesetzt wird und dem Gehirn einen leeren Magen signalisiert. Ghrelin ist der endogene Ligand für den G-Protein-gekoppelten Ghrelin-Rezeptor (auch GHS-Rezeptor genannt). Es wirkt auf eine Reihe von physiologischen Vorgängen, unter anderem vermag es das Wachstumshormon (GH) aus dem Hypophysenvorderlappen freizusetzen. Im Gehirn wirkt Ghrelin regulatorisch auf Nahrungsaufnahme, Körpergewicht und Glucosestoffwechsel und vermag eine Kachexie zu verhindern oder zu verbessern.
Anamorelin wirkt agonistisch, hochaffin und selektiv am Ghrelin-Rezeptor. Es ist oral wirksam und bedarf der nur einmal täglichen Gabe.[3] Die Elimination zeigt einen biexponetiellen Verlauf, mit einer mittleren terminalen Halbwertszeit von 6 bis 8 Stunden.[5]
Entwicklung und Vermarktung
BearbeitenAnamorelin wurde im Januar 2021 in Japan zur Behandlung der krebsbedingten Kachexie bei bösartigem nicht-kleinzelligem Lungenkrebs (NCSLC), Magenkrebs, Bauchspeicheldrüsenkrebs und Dickdarmkrebs bedingt zugelassen.[6] Die pharmazeutische Entwicklung erfolgte durch die Schweizer Pharmafirma Helsinn, der Betrieb der Zulassung und die Markteinführung in Japan im April 2021 durch den Partner Ono Pharmaceutical.[7]
Die Europäische Arzneimittelagentur (EMA) hatte im Mai 2017 von einer Zulassung zur Behandlung von Anorexie und Kachexie bei NCSCL-Patienten abgeraten, da sie die Wirksamkeit als nicht ausreichend nachgewiesen und die Sicherheit als nicht zuverlässig ermittelt ansah. Die vorgelegten Ergebnisse basierten auf den beiden ROMANA-Studien 1 und 2. Die EMA bestätigte ihr Urteil im September 2017 nach einer erneuten Bewertung auf Anfrage des Antragstellers, der Firma Helsinn Birex.[8]
Studien
BearbeitenROMANA
BearbeitenIn zwei randomisierten doppelblinden Phase-3-Studien (ROMANA 1[9] und ROMANA 2[10]) mit insgesamt fast 1000 Patienten mit nicht kleinzelligem Lungenkarzinom (NCSLC) im Endstadium mit Kachexie wurde Anamorelin im Vergleich zu Placebo (Scheinmedikament) untersucht. Hauptindikatoren für die Wirksamkeit waren Veränderungen des Magergewichts des Körpers (Körpergewicht ohne Fettmasse) und der Griffstärke der Hand. Das Magergewicht wurde nach einer 12-wöchigen Therapie leicht gesteigert (0,99 kg vs. −0,47 kg in ROMANA 1 und 0,65 kg vs. −0,98 kg in ROMANA 2). Eine Verbesserung der Muskelkraft wurde nicht erzielt. Die häufigsten Nebenwirkungen von Anamorelin waren Hyperglykämie und Übelkeit.[11]
Japan
BearbeitenDie japanische Zulassung beruht auf zwei klinischen Studien aus Japan.[12] Eine Phase-2-Studie über 12 Wochen an 174 Patienten mit NCSLC im Stadium III/IV und Kachexie führte zu einem Unterschied des Magergewichts um durchschnittlich 1,56 kg zwischen Verum- (echtes Medikament) und Placebogruppe (Scheinmedikament). Ebenso unterschieden sich das Gesamtkörpergewicht und die anorektische Symptomatik in der Verumgruppe signifikant von der Placebogruppe. Die Messung der Handgriffstärke oder der 6-Minuten-Geht-Test erbrachte keine signifikanten Unterschiede.[13] Eine weitere Studie untersuchte 50 Patienten mit fortgeschrittenem und nicht resezierbaren Kolorektal-, Magen- oder Bauchspeicheldrüsenkrebs. Sie zeigte eine Steigerung des Magergewichts um durchschnittlich 1,89 kg. Funktionelle Endpunkte wie Muskelkraft und körperliche Funktion wurden in dieser Studie nicht bewertet.[14]
Handelsnamen
BearbeitenAdlumiz (J)
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 59, World Health Organisation (WHO), 9. März 2008.
- ↑ a b c d e f Datenblatt Anamorelin bei Sigma-Aldrich, abgerufen am 26. Juni 2021 (PDF).
- ↑ a b c Assessment report Adlumiz, Ausschuss für Humanarzneimittel, 14. September 2017.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Anamorelinhydrochlorid: CAS-Nummer: 861998-00-7, PubChem: 16072155, ChemSpider: 17231641, Wikidata: Q27261306.
- ↑ P.T. Leese: An open-label clinical trial of the effects of age and gender on the pharmacodynamics, pharmacokinetics and safety of the ghrelin receptor agonist anamorelin. In: Clinical Pharmacology in Drug Development. März 2015, doi:10.1002/cpdd.175.
- ↑ ONO Receives a Manufacturing and Marketing Approval of Adlumiz® (Anamorelin), a Ghrelin Receptor Agonist for the Treatment of Cancer Cachexia in Japan, www.globenewswire.com, 22. Januar 2021.
- ↑ Helsinn Announces the Launch of Adlumiz® (anamorelin) for the Treatment of Cancer Cachexia in Japan, Pressemitteilung Helsinn, 21. April 2021.
- ↑ EPAR – Adlumiz, Europäische Arzneimittelagentur, 14. September 2017.
- ↑ Klinische Studie (Phase 3): Safety and Efficacy of Anamorelin HCl in Patients With Non-Small Cell Lung Cancer-Cachexia (ROMANA 1) bei Clinicaltrials.gov der NIH
- ↑ Klinische Studie (Phase 3): Safety and Efficacy of Anamorelin HCl in Patients With Non-Small Cell Lung Cancer-Cachexia (ROMANA 2) bei Clinicaltrials.gov der NIH
- ↑ J.S. Teme: Anamorelin in patients with non-small-cell lung cancer and cachexia (ROMANA 1 and ROMANA 2): results from two randomised, double-blind, phase 3 trials. In: The Lancet. Oncology. Band 15, Nr. 4, April 2016, S. 519–531, doi:10.1016/S1470-2045(15)00558-6.
- ↑ H. Wakabayashi, H. Arai, A Inui: The regulatory approval of anamorelin for treatment of cachexia in patients with non-small cell lung cancer, gastric cancer, pancreatic cancer, and colorectal cancer in Japan: facts and numbers. In: Journal of Cachexia, Sarcopenia and Muscle. Februar 2021, doi:10.1002/jcsm.12675.
- ↑ N. Katakami et al.: Anamorelin (ONO‐7643) for the treatment of patients with non–small cell lung cancer and cachexia: Results from a randomized, double‐blind, placebo‐controlled, multicenter study of Japanese patients (ONO‐7643‐04). In: Cancer. Januar 2018, doi:10.1002/cncr.31128.
- ↑ S. Hamauchi et al.: A multicenter, open‐label, single‐arm study of anamorelin (ONO‐7643) in advanced gastrointestinal cancer patients with cancer cachexia. In: Cancer. Dezember 2019, doi:10.1002/cncr.32406.