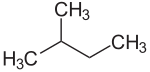
Isopentan, systematisch 2-Methylbutan oder auch nur Methylbutan ist eine organische chemische Verbindung. Sie gehört systematisch zu den Alkanen. Es ist eines von drei Strukturisomeren der Pentane (n-Pentan, Isopentan, Neopentan). Isopentan besitzt dementsprechend fünf C-Atome und hat die Summenformel C5H12. Isopentan ist eine hochentzündliche, schon bei leicht erhöhter Raumtemperatur siedende Flüssigkeit.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Isopentan | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H12 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit benzinartigem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 72,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||||||||
| Dichte |
0,62 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
28 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,35373[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
1000 ml·m−3 bzw. 3000 mg·m−3[2] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
BearbeitenDie Darstellung erfolgt vor allem durch katalytische Isomerisierung von n-Pentan.[6]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenIsopentan ist eine farblose, leicht flüchtige Flüssigkeit, die unter Normaldruck bei 28 °C siedet.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 3,90935, B = 1018,516 und C = −40,081 im Temperaturbereich von 190,3 K bis 300,9 K.[7]
Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−178,2 kJ·mol−1[8] −153,7 kJ·mol−1[8] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −3504,4 kJ·mol−1[8] | als Flüssigkeit |
| Wärmekapazität | cp | 164,5 J·mol−1·K−1 (25 °C)[9] 2,27 J·g−1·K−1 (25 °C) |
als Flüssigkeit |
| Kritische Temperatur | Tc | 460,4 K[10] | |
| Kritischer Druck | pc | 33,8 bar[10] | |
| Kritisches Volumen | Vc | 0,306 l·mol−1[10] | |
| Kritische Dichte | ρc | 3,27 mol·l−1[10] | |
| Schmelzenthalpie | ΔfH | 5,13 kJ·mol−1[11] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 24,69 kJ·mol−1[12] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 39,02 kJ/mol, β = 0,267 und Tc = 460,4 K im Temperaturbereich zwischen 279 K und 301 K beschreiben.[12]
Sicherheitstechnische Kenngrößen
BearbeitenIsopentan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −57 °C.[2] Der Explosionsbereich liegt zwischen 1,3 Vol.-% (38 g/m3) als untere Explosionsgrenze (UEG) und 7,6 Vol.-% (230 g/m3) als obere Explosionsgrenze (OEG).[2][13] Mit einer Mindestzündenergie von 0,21 mJ sind Dampf-Luft-Gemische extrem zündfähig.[2][14] Der maximale Explosionsdruck beträgt 9,1 bar.[2] Die Grenzspaltweite wurde mit 0,98 mm bestimmt.[2][13] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[13][2] Die Zündtemperatur beträgt 420 °C.[13][2] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
BearbeitenIsopentan wird als Lösungsmittel für Fette und Öle sowie zur Herstellung von Isopren und Insektiziden benutzt.[6] Isopentan wird als Treibmittel bei Rasiergel verwendet, da es erst im Kontakt mit der wärmeren Hautoberfläche siedet und dadurch das Gel aufschäumen lässt. Es kann außerdem, wie zum Beispiel im Geothermiekraftwerk Landau, auch als Arbeitsmedium beim Organic Rankine Cycle verwendet werden. In der Histologie wird tiefgekühltes Isopentan zum Schockgefrieren von Gewebeproben verwendet.[15][16]
Weblinks
BearbeitenEinzelnachweise
Bearbeiten- ↑ Eintrag zu ISOPENTANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- ↑ a b c d e f g h i j k l m n o p q r s t Eintrag zu Isopentan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Datenblatt Isopentan bei Merck, abgerufen am 25. September 2006.
- ↑ CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. 1984, ISBN 0-8493-0303-6.
- ↑ Eintrag zu 2-methylbutane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b H. Breuer: dtv-Atlas zur Chemie. Band 2, Februar 1997.
- ↑ D. R. Stull: Vapor Pressure of Pure Substances – Organic Compounds. In: Ind. Eng. Chem. 39, 1947, S. 517–540. doi:10.1021/ie50448a022
- ↑ a b c W. D. Good: The enthalpies of combustion and formation of the isomeric pentanes. In: J. Chem. Thermodyn. 2, 1970, S. 237–244. doi:10.1016/0021-9614(70)90088-1.
- ↑ I. Czarnota: Heat capacity of 2-methylbutane at high pressures. In: J. Chem. Thermodyn. 20, 1988, S. 457–462. doi:10.1016/0021-9614(88)90183-8.
- ↑ a b c d T. E. Daubert: Vapor-Liquid Critical Properties of Elements and Compounds. 5. Branched Alkanes and Cycloalkanes. In: J. Chem. Eng. Data. 41, 1996, S. 365–372. doi:10.1021/je9501548.
- ↑ Eugene S. Domalski, Elizabeth D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1, 1996. doi:10.1063/1.555985.
- ↑ a b V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ BG RCI-Merkblatt T 033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen. Jedermann-Verlag, 2009, ISBN 978-3-86825-103-6.
- ↑ John D. Bancroft, Marilyn Gamble: Theory and Practice of Histological Techniques. Elsevier Health Sciences, 2008, ISBN 978-0-443-10279-0, S. 99. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Michael Arnold: Histochemie. Springer-Verlag, 2013, ISBN 978-3-642-49933-3, S. 92. (eingeschränkte Vorschau in der Google-Buchsuche).



