| Entdecker | Jahr | Reagenzien | Kurzbeschreibung | Zielmolekül(e) | Quelle |
|---|---|---|---|---|---|
| Eastwood-Reaktion | |||||
| F.W. Eastwood | 1964 | vicinale Diole, Orthoameisensäuretriethylester | Umesterung, thermische Zersetzung | Olefine | [1] |

| |||||
| Eder-Reaktion | |||||
| Josef Maria Eder | 1880 | Quecksilber(II)-chlorid, Oxalate, Photosensibilisatoren | photochemische Reduktion | Quecksilber(I)-chlorid | [2] |

| |||||
| Edman-Abbau | |||||
| Pehr Edman | 1949 | Aminsosäuren, Phenylisothiocyanat | schrittweiser Abbau einer Aminosäurensequenz | [3] | |

| |||||
| Eglinton-Kupplung | |||||
| G. Eglinton | 1956 | Alkine, Kupferacetat, Pyridin | Kupplung | Dialkine | [4] |
| Ehrlich-Sachs-Reaktion | |||||
| Paul Ehrlich, Franz Sachs | 1899 | aromatische Nitrosoverbindungen, Verbindungen mit aktivierten Methylengruppen | Kondensation | N-Phenylimine | [5] |

| |||||
| Einhorn-Brunner-Reaktion | |||||
| Alfred Einhorn, Karl Brunner | 1905/ 1914 | Hydrazine, Diacylamine | 1,2,4-Triazole | [6][7] | |

| |||||
| Einhorn-Acylierung (Einhorn-Reaktion) | |||||
| Alfred Einhorn | 1898 | Säurechloride, Alkohole, Pyridin | Schotten-Baumann-Reaktion | Carbonsäureester | [8] |

| |||||
| Eisleb-Alkylierung | |||||
| Otto Eisleb | 1941 | CH-acide Verbindungen, Natriumamid, Alkylhalogenide | Abspaltung eines Protons, nukleophile Substitution | Bildung einer C-C-Bindung | [9] |

| |||||
| Elbs-Persulfatoxidation | |||||
| Karl Elbs | 1893 | Phenole, Kaliumperoxidisulfat | Oxidation | Chinone | [10] |

| |||||
| Elbs-Reaktion | |||||
| Karl Elbs | 1884 | ortho-methylierte aromatische Acyle | Pyrolyse | mehrkernige Aromaten | [11] |
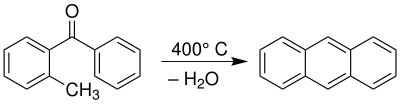
| |||||
| Eltekoff-Hydrolyse | |||||
| A. Eltekoff | 1875 | Vinylhalogenide, alkalische Lösung | Hydrolyse | Aldehyde/Ketone | [12] |

| |||||
| Emde-Abbau | |||||
| Hermann Emde | 1909 | quartäre Ammoniumverbindungen, Natriumamalgam | Reduktion | tertiäre Amine | [13] |

| |||||
| Emmert-Reaktion | |||||
| Bruno Emmert, Erich Asendorf | 1939 | Pyridin, Ketone, Magnesium, Quecksilber(II)-chlorid | α-Pyridyl-dialkyl-carbinole | [14] | |

| |||||
| Enders SAMP/RAMP-Hydrazonalkylierung | |||||
| Dieter Enders | 1976 | Ketone, Enders-Reagenz, Lithiumdiisopropylamid, Alkylhalogenide | Hydrazonbildung, Deprotonierung, nukleophile Substitution, Hydrolyse | stereoselektiv α-alkylierte Ketone | [15] |
| Engler-Indolsynthese | |||||
| Thomas A. Engler | 1995 | Styrole/Enolether, Benzochinonimine, Lewis-Säure | Indole | [16] | |
| Enyne-Metathese | |||||
| Thomas J. Katz, Timothy M. Sivavec (benannt nach Molekülgruppen) | 1985 | Alkine, Alkene | Metathese | Diene | [17] |
| Erlenmeyer-Plöchl-Azolactonsynthese | |||||
| Friedrich Gustav Karl Emil Erlenmeyer, J. Plöchl | 1884/1893 | Acylglycine, Essigsäureanhydrid | intramolekulare Konsensation | 5-Oxazolone | [18] |

| |||||
| Erlenmeyer-Bergmann-Plöchl-Aminosäuresynthese | |||||
| Friedrich Gustav Karl Emil Erlenmeyer, Max Bergmann, J. Plöchl | 1884/1893 | Hydantoin, Aldehyde | Aminosäuren | [19][20][21] | |
| Eschenmoser-Claisen-Umlagerung | |||||
| Albert Eschenmoser | 1964 | Allylalkohole, N,N-Dimethylacetamidimethylacetal | Bildung eines Iminiumions, Reaktion mit Alkohol unter Methanolabspaltung, Claisen-Umlagerung | γ,δ-ungesättigte Amide | [22] |
| Eschenmoser-Fragmentierung | |||||
| Albert Eschenmoser | 1967 | α,β-Epoxyketone, Arylsulfonsäurehydrazid, Base/Säure | Kondensation, Fragmentierung unter Stickstoffabspaltung | Alkine, Ketone | [23] |

| |||||
| Eschenmoser-Methenylierung | |||||
| Albert Eschenmoser | 1971 | Ketone, Eschenmoser-Salz, Methyliodid oder MCPBA | Addition in α-Position, Deprotonierung/Oxidation, Eliminierung | α-methenylierte Ketone | [24] |
| Eschenmoser-Kupplung | |||||
| Albert Eschenmoser | 1967 | Thioamide, Alkylhalogenide, Base, Thiophil (z.B. Triphenylphosphin) | Alkylierung des Schwefels, Deprotonierung, Eliminierung von Schwefel | Enamine | [25] |

| |||||
| Eschenmoser-Olefinierung | |||||
| Albert Eschenmoser | 1972 | Ketone, N-Aminoaziridine | Bildung eines Aziridinylhydrazons, Zersetzung | Alkene | [26] |
| Eschenmoser-Sulfidkontraktion | |||||
| Albert Eschenmoser | 1971 | Thiolsäuren, α-Halogenketone,Phosphine | Bildung eines Thioesters, Eliminierung von Schwefel | 1,3-Dicarbonylverbindungen | [27] |
| Eschweiler-Clarke-Methylierung | |||||
| Wilhelm Eschweiler, Hans Thacher Clarke | 1905 | Amine, Formaldehyd, Ameisensäure | reduktive Methylierung | tertiäre Amine | [28] |

| |||||
| Étard-Reaktion | |||||
| Alexandre Léon Étard | 1880 | alkylsubstituierter Aromaten, Chrom(VI)-oxiddichlorid | Oxidation | Aldehyde | [29] |

| |||||
| Evans-Aldol-Reaktion | |||||
| David Evans | 1981 | Aldehyde, Evans-Auxiliar | assymetrische Aldol-Reaktion | β-Hydroxyaldehyde | [30] |
| Evans-Tischenko-Reaktion | |||||
| David Evans | 1990 | β-Hydroxyketone, Aldehyde, Samarium(II)-iodid | diastereoselektive Reduktion | 1,3-anti-Diolmonoester | [31] |

| |||||
Quellen Bearbeiten
- ↑ G. Crank, F. W. Eastwod: Derivatives of orthoacids. I. Bicyclic orthoesters. In: Australian Journal of Chemistry. 17, 1964, S. 1385, doi:10.1071/CH9641385.
- ↑ J. M. Eder: Ueber die Reduction des Quecksilberchlorides im Lichte. In: Zeitschrift für Analytische Chemie. 19, 1880, S. 351, doi:10.1007/BF01341025.
- ↑ P. Edman: A method for the determination of amino acid sequence in peptides. In: Archives of biochemistry. Band 22, Nummer 3, Juli 1949, S. 475, PMID 18134557.
- ↑ G. Eglinton, A.R. Galbraith. In: Chem. Ind. (London) 1956, S. 737-738.
- ↑ Paul Ehrlich, Franz Sachs: Ueber Condensationen von aromatischen Nitrosoverbindungen mit Methylenderivaten. In: Berichte der deutschen chemischen Gesellschaft. 32, 1899, S. 2341–2346, doi:10.1002/cber.189903202172.
- ↑ Alfred Einhorn, Eduard Bischkopff, Bruno Szelinski, Gustav Schupp, Eduard Spr ngerts, Carl Ladisch, Theodor Mauermayer: Ueber die N-Methylolverbindungen der Säureamide [Erste Abhandlung.]. In: Justus Liebig's Annalen der Chemie. 343, 1905, S. 207–305, doi:10.1002/jlac.19053430207.
- ↑ Karl Brunner: Eine neue Darstellungsweise von sekundären Säureamiden. In: Berichte der deutschen chemischen Gesellschaft. 47, 1914, S. 2671–2680, doi:10.1002/cber.19140470351.
- ↑ Alfred Einhorn, Friedrich Hollandt, Mitgetheilt Von Alfred Einhorn: Ueber die Acylirung der Alkohole und Phenole in Pyridinlösung. In: Justus Liebig's Annalen der Chemie. 301, 1898, S. 95, doi:10.1002/jlac.18983010111.
- ↑ Otto Eisleb: Neue Synthesen mittels Natriumamids. In: Berichte der deutschen chemischen Gesellschaft. 74, 1941, S. 1433, doi:10.1002/cber.19410740814.
- ↑ K. Elbs: Ueber Nitrohydrochinon. In: Journal für Praktische Chemie. 48, 1893, S. 179–185, doi:10.1002/prac.18930480123.
- ↑ Karl Elbs, Einar Larsen: Ueber Paraxylylphenylketon. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 2847–2849, doi:10.1002/cber.188401702247.
- ↑ A. Eltekoff: Vorläufige Mittheilung. In: Berichte der deutschen chemischen Gesellschaft. 8, 1875, S. 1244, doi:10.1002/cber.187500802103.
- ↑ Hermann Emde: Spaltung quartärer Ammoniumsalze durch nascierenden Wasserstoff. In: Berichte der deutschen chemischen Gesellschaft. 42, 1909, S. 2590–2594, doi:10.1002/cber.190904202169.
- ↑ Bruno Emmert, Erich Asendorf: Eine Synthese von α-Pyridyl-dialkyl-carbinolen. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 72, 1939, S. 1188–1194, doi:10.1002/cber.19390720610.
- ↑ E.J. Corey, Dieter Enders: Applications of N,N-dimethylhydrazones to synthesis. Use in efficient, positionally and stereochemically selective C—C bond formation; oxidative hydrolysis to carbonyl compounds. In: Tetrahedron Letters. 17, 1976, S. 3–6, doi:10.1016/S0040-4039(00)71307-4.
- ↑ Thomas A. Engler, Wenying Chai, Kenneth O. Lynch: Switchable regioselectivity in lewis acid-promoted reactions of 1,4-benzoquinone monoimides with styrenyl systems: Selective syntheses of either 2-aryl-2,3-dihydrobenzofurans or 2-aryl-2,3-dihydroindoles. In: Tetrahedron letters. 1995, Band 36, Nummer 39, S. 7003–7006 doi:10.1016/0040-4039(95)01449-R.
- ↑ Thomas J. Katz, Timothy M. Sivavec: Metal-catalyzed rearrangement of alkene-alkynes and the stereochemistry of metallacyclobutene ring opening. In: Journal of the American Chemical Society. 107, 1985, S. 737–738, doi:10.1021/ja00289a054.
- ↑ J. Ploechl: Ueber einige Derivate der Benzoylimidozimmtsaeure. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 1616–1624, doi:10.1002/cber.18840170215; Emil Erlenmeyer jun.: Ueber die Condensation der Hippursaeure mit Phtalsaeureanhydrid und mit Benzaldehyd. In: Justus Liebig's Annalen der Chemie. 275, 1893, S. 1–8, doi:10.1002/jlac.18932750102.
- ↑ E. Erlenmeyer jun: Ueber eine neue Phenylamidomilchsäure aus Glycocoll und Benzaldehyd. In: Berichte der deutschen chemischen Gesellschaft. 25, 1892, S. 3445, doi:10.1002/cber.189202502212.
- ↑ Max Bergmann, Ferdinand Stern, Charlotte Witte: Über neue Verfahren der Synthese von Dipeptiden und Dipeptid-Anhydriden. In: Justus Liebig's Annalen der Chemie. 449, 1926, S. 277, doi:10.1002/jlac.19264490116.
- ↑ J. Plöchl: Ueber einige Derivate der Benzoylimidozimmtsäure. In: Berichte der deutschen chemischen Gesellschaft. 17, 1884, S. 1616, doi:10.1002/cber.18840170215.
- ↑ A. E. Wick, Dorothee Felix, Katharina Steen, A. Eschenmoser: Claisen'sche Umlagerungen bei Allyl- und Benzylalkoholen mit Hilfe von Acetalen des N, N-Dimethylacetamids. Vorläufige Mitteilung. In: Helvetica Chimica Acta. 47, 1964, S. 2425, doi:10.1002/hlca.19640470835.
- ↑ J. Schreiber, Dorothee Felix, A. Eschenmoser, M. Winter, F. Gautschi, K. H. Schulte-Elte, E. Sundt, G. Ohloff, J. Kalovoda, H. Kaufmann, P. Wieland, G. Anner: Die Synthese von Acetylen-carbonyl-Verbindungen durch Fragmentierung von α,β-Epoxy-ketonen mit p-Toluolsulfonylhydrazin. In: Helvetica Chimica Acta. 50, 1967, S. 2101, doi:10.1002/hlca.19670500747.
- ↑ Jakob Schreiber, Hans Maag, Naoto Hashimoto, Albert Eschenmoser: Dimethyl-methylen-immonium-jodid. In: Angewandte Chemie. 83, 1971, S. 355, doi:10.1002/ange.19710831005.
- ↑ A. Fischli, A. Eschenmoser: Ein synthetischer Zugang zu metallfreien Corrinen. In: Angewandte Chemie. 79, 1967, S. 865, doi:10.1002/ange.19670791913.
- ↑ Dorothee Felix, Robert K. Müller, U. Horn, R. Joos, J. Schreiber, A. Eschenmoser: α,β-Epoxyketon → Alkinon-Fragmentierung II: Pyrolytischer Zerfall der Hydrazone aus α,β-Epoxyketonen und N-Amino-aziridinen. Über synthetische Methoden, 4. Mitteilung. In: Helvetica Chimica Acta. 55, 1972, S. 1276, doi:10.1002/hlca.19720550424.
- ↑ M. Roth, P. Dubs, E. Götschi, A. Eschenmoser: Sulfidkontraktion via alkylative Kupplung: Eine Methode zur Darstellung von β-Dicarbonylderivaten. Über synthetische Methoden, 1. Mitteilung. In: Helvetica Chimica Acta. 54, 1971, S. 710, doi:10.1002/hlca.19710540229.
- ↑ Wilhelm Eschweiler: Ersatz von an Stickstoff gebundenen Wasserstoffatomen durch die Methylgruppe mit Huelfe von Formaldehyd. In: Berichte der deutschen chemischen Gesellschaft. 38, 1905, S. 880–882, doi:10.1002/cber.190503801154; H. T. Clarke, H. B. Gillespie, S. Z. Weisshaus: The Action of Formaldehyde on Amines and Amino Acids. In: J. Am. Chem. Soc. 1933, 55, 11, S. 4571–4587, doi:10.1021/ja01338a041.
- ↑ A. Étard: Sur la synthèse des aldéhydes aromatiques; essence de cumin. In: Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences. 1880, 90, 534 (Digitalisat auf Gallica).
- ↑ D. A. Evans, J. Bartroli, T. L. Shih: Enantioselective aldol condensations. 2. Erythro-selective chiral aldol condensations via boron enolates. In: Journal of the American Chemical Society. 103, 1981, S. 2127–2129, doi:10.1021/ja00398a058.
- ↑ David A. Evans, Amir H. Hoveyda: Samarium-catalyzed intramolecular Tishchenko reduction of .beta.-hydroxy ketones. A stereoselective approach to the synthesis of differentiated anti 1,3-diol monoesters. In: Journal of the American Chemical Society. 1990, Band 112, Nummer 17, S. 6447–6449 doi:10.1021/ja00173a071.