Xanomelin
Xanomelin ist ein Arzneistoff aus der Gruppe der selektiven Muskarinrezeptor-Agonisten. Für die fixe Kombination von Xanomelin mit dem Muskarinrezeptor-Antagonisten Trospium erteilte die Food and Drug Administration (FDA) im September 2024 die Zulassung zur Behandlung von Schizophrenie bei Erwachsenen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
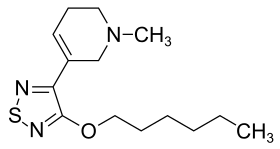
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Xanomelin[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H23N3OS | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse |
Neuroleptika | |||||||||||||||||||||
| Wirkmechanismus |
Muskarinrezeptor-Agonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 281,41 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Wirkungsmechanismus
BearbeitenPräklinische Daten stützen die Hypothese, dass der zentrale Wirkmechanismus von Xanomelin in erster Linie durch die Stimulierung von M4- und M1-Muskarinrezeptoren im Gehirn vermittelt wird.[3] M4-Muskarinrezeptoren werden am stärksten im Mittelhirn reguliert, das Motorik und Handlungsplanung, Entscheidungsfindung, Motivation, Verstärkung und Belohnungswahrnehmung kontrolliert. M1-Muskarinrezeptoren sind in den Regionen der Großhirnrinde am stärksten ausgeprägt, die übergeordnete Prozesse wie Sprache, Gedächtnis, Denken, Lernen, Entscheidungsfindung, Emotionen, Intelligenz und Persönlichkeit regulieren.[4] Im Gegensatz zu direkten Dopamin-D2- und Serotonin-5HT2A-Blockern unter den antipsychotischen Medikamenten bringt die Stimulierung der M4- und M1-Rezeptoren die dopaminergen und glutamatergen Synapsen, die an den Symptomen neurologischer und neuropsychiatrischer Erkrankungen wie Schizophrenie und Alzheimer beteiligt sind, indirekt wieder ins Gleichgewicht. Ausgehend von präklinischen pharmakologischen und genetischen Studien scheinen M4-Rezeptoren sowohl den Bereich der Psychose als auch den der kognitiven Symptome zu modulieren, während M1 vorwiegend den Bereich der kognitiven Symptome moduliert und den Bereich der Psychose-Symptome in geringem Maße reguliert.[5][6]
Geschichte
BearbeitenXanomelin wurde erstmals im Rahmen einer Zusammenarbeit zwischen den Pharmaunternehmen Eli Lilly und Novo-Nordisk mit dem Ziel synthetisiert, den kognitiven Verfall bei Patienten mit Alzheimer-Krankheit zu verzögern. In einer Phase-2-Studie wurden bei Alzheimer-Patienten signifikante Verbesserungen der kognitiven Fähigkeiten sowie überraschende Verbesserungen der psychotischen Symptome beobachtet.[7] In einer anschließenden placebokontrollierten Studie bei Patienten mit behandlungsresistenter Schizophrenie wurde mit Xanomelin eine ähnliche antipsychotische Wirkung beobachtet.[8] Allerdings verhinderten cholinergisch bedingte Nebenwirkungen eine Weiterentwicklung von Xanomelin in Phase-3-Studien. Xanomelin wurde 2012 an Karuna Therapeutics lizenziert und wurde anschließend in Kombination mit Trospium entwickelt („KarXT“). Trospium ist ein nicht hirndurchdringender und nicht selektiver Muskarinrezeptorblocker, der die peripheren Nebenwirkungen von Xanomelin abmildern kann. In einer placebokontrollierten klinischen Studie der Phase 2 im Jahr 2021 erreichte KarXT den primären Endpunkt.[9] Im März 2023 erreichte die Kombination nach Angaben von Karuna Therapeutic den primären Endpunkt in einer Phase-3-Studie, EMERGENT-3,[10] und im November 2023 begann die FDA mit der Prüfung eines Zulassungsantrages.[11] Zum Jahreswechsel 2023 / 2024 wurde Karuna Therapeutics für ca. 14 Mrd. US-Dollar von Bristol-Myers Squibb (BMS) übernommen,[12] im September 2024 erging die US-Zulassung zur Behandlung von Schizophrenie bei Erwachsenen (Präparatename: Cobenfy).[13]
Bei der Europäischen Arzneimittelagentur (EMA) liegt bislang kein Zulassungsantrag für Xanomelin/Trospiumchlorid vor.[14]
Weblinks
Bearbeiten- Martina Hahn: Neue Hoffnung bei Schizophrenie. Deutsche Apotheker Zeitung, 15. April 2021.
- S. Siebenand: Xanomelin-Trospium bei Schizophrenie erfolgreich. In: pharmazeutische-zeitung.de. 12. August 2022.
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 34, World Health Organisation (WHO), 9. September 1994.
- ↑ a b Datenblatt 3-(Hexyloxy)-4-(1-methyl-1,2,5,6-tetrahydropyridin-3-yl)-1,2,5-thiadiazole (PDF) bei BLD Pharmatech, Katalognummer: BD101028, abgerufen am 25. März 2024.
- ↑ Harlan E. Shannon, Kurt Rasmussen, Frank P. Bymaster, John C. Hart, Steven C. Peters, Michael D.B. Swedberg, Lone Jeppesen, Malcolm J. Sheardown, Per Sauerberg, Anders Fink-Jensen: Xanomeline, an M1/M4 preferring muscarinic cholinergic receptor agonist, produces antipsychotic-like activity in rats and mice. In: Schizophrenia Research. 42. Jahrgang, Nr. 3, Mai 2000, S. 249–259, doi:10.1016/s0920-9964(99)00138-3, PMID 10785583.
- ↑ Laura A. Volpicelli, Allan Levey: Muscarinic acetylcholine receptor subtypes in cerebral cortex and hippocampus. 2004, abgerufen am 21. März 2024.
- ↑ Marie L. Woolley, Helen J. Carter, Jane E. Gartlon, Jeanette M. Watson, Lee A. Dawson: Attenuation of amphetamine-induced activity by the non-selective muscarinic receptor agonist, xanomeline, is absent in muscarinic M4 receptor knockout mice and attenuated in muscarinic M1 receptor knockout mice. In: European Journal of Pharmacology. 603. Jahrgang, Nr. 1–3, Januar 2009, S. 147–149, doi:10.1016/j.ejphar.2008.12.020, PMID 19111716.
- ↑ Steven M. Paul, Samantha E. Yohn, Michael Popiolek, Andrew C. Miller, Christian C. Felder: Muscarinic Acetylcholine Receptor Agonists as Novel Treatments for Schizophrenia. In: American Journal of Psychiatry. 179. Jahrgang, Nr. 9, 27. Juni 2022, S. 611–627, doi:10.1176/appi.ajp.21101083, PMID 35758639.
- ↑ N. C. Bodick, W. W. Offen, A. I. Levey, N. R. Cutler, S. G. Gauthier, A. Satlin, H. E. Shannon, G. D. Tollefson, K. Rasmussen, F. P. Bymaster, D. J. Hurley: Effects of Xanomeline, a Selective Muscarinic Receptor Agonist, on Cognitive Function and Behavioral Symptoms in Alzheimer Disease. In: Archives of Neurology. 54. Jahrgang, Nr. 4, 1. April 1997, S. 465–473, doi:10.1001/archneur.1997.00550160091022, PMID 9109749.
- ↑ Anantha Shekhar, William Z. Potter, Jeffrey Lightfoot, John Lienemann, Sanjay Dubé, Craig Mallinckrodt, Frank P. Bymaster, David L. McKinzie, Christian C. Felder: Selective Muscarinic Receptor Agonist Xanomeline as a Novel Treatment Approach for Schizophrenia. In: American Journal of Psychiatry. 165. Jahrgang, Nr. 8, August 2008, S. 1033–1039, doi:10.1176/appi.ajp.2008.06091591, PMID 18593778.
- ↑ Stephen K. Brannan, Sharon Sawchak, Andrew C. Miller, Jeffrey A. Lieberman, Steven M. Paul, Alan Breier: Muscarinic Cholinergic Receptor Agonist and Peripheral Antagonist for Schizophrenia. In: The New England Journal of Medicine. 384. Jahrgang, Nr. 8, 25. Februar 2021, S. 717–726, doi:10.1056/NEJMoa2017015, PMID 33626254, PMC 7610870 (freier Volltext).
- ↑ Alexis Smith: Karuna Therapeutics Announces Positive Results from Phase 3 EMERGENT-3 Trial of KarXT in Schizophrenia. 20. März 2023, abgerufen am 20. März 2024.
- ↑ Phil Taylor: FDA kicks off review of Karuna’s schizophrenia drug KarXT. pharmaphorum, 29. November 2023, abgerufen am 21. März 2024.
- ↑ Bristol Myers Squibb - Bristol Myers Squibb Completes Acquisition of Karuna Therapeutics, Strengthening Neuroscience Portfolio. In: news.bms.com. 26. September 2024, abgerufen am 27. September 2024 (englisch).
- ↑ FDA Approves Drug with New Mechanism of Action for Treatment of Schizophrenia, Pressemitteilung der FDA vom 26. September 2024, abgerufen am 27. September 2024
- ↑ Neues Wirkprinzip bei Schizophrenie, Pharmazeutische Zeitung vom 27. September 2024, abgerufen am 27. September 2024