Tetrasauerstoffdifluorid
Tetrasauerstoffdifluorid ist eine anorganische chemische Verbindung des Sauerstoffs aus der Gruppe der Sauerstofffluoride. Sie besteht aus zwei über eine schwache OO-Bindung verbundenen O2F-Molekülhälften. Es ist das Dimer des O2F-Radikals.[1]
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
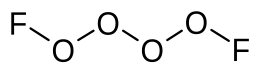
| |||||||
| Allgemeines | |||||||
| Name | Tetrasauerstoffdifluorid | ||||||
| Andere Namen |
Difluortetraoxid | ||||||
| Summenformel | O4F2 | ||||||
| Kurzbeschreibung |
rotbrauner Feststoff (T < −191 °C)[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 102,00 g·mol−1 | ||||||
| Schmelzpunkt | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Gewinnung und Darstellung
BearbeitenTetrasauerstoffdifluorid kann in zwei Schritten gewonnen werden. Im ersten Schritt werden hier photochemisch erzeugte Fluor-Atome mit Sauerstoff zur Reaktion gebracht, um Disauerstoffmonofluorid-Radikale zu erzeugen:[4]
Die dann anschließend in einer Gleichgewichtsreaktion zu Tetrasauerstoffdifluorid dimerisieren, dies geschieht bei Temperaturen unterhalb von −175 °C:[1][4]
Parallel zersetzen sich die Disauerstoffmonofluorid-Radikale zu Disauerstoffdifluorid und Sauerstoff, wodurch sich das obige Gleichgewicht autonom auf die linke Seite verschiebt:[4]
Eigenschaften
BearbeitenTetrasauerstoffdifluorid ist als Feststoff dunkelrotbraun und besitzt einen Schmelzpunkt von −191 °C.[1]
Es ist ein starkes Fluorierungs- und Oxidationsmittel, stärker noch als Disauerstoffdifluorid[1], so vermag es z. B. Ag(II) zu Ag(III), oder Au(III) zu Au(V) zu oxidieren. Dieser Prozess bringt die entsprechenden Fluorid-Anionen bzw. hervor.[1] Mit unedleren Stoffen führt die Oxidation selbst bei niedrigsten Temperaturen zu einer Explosion, z. B. wird elementarer Schwefel selbst bei −180 °C explosionsartig in Schwefelhexafluorid überführt.[1]
Tetrasauerstoffdifluorid neigt ähnlich wie oder dazu, mit Fluoridion-Akzeptoren wie Bortrifluorid ( ) zu Salzen mit dem Oxygenyl-Ion ( ) zu reagieren.[1] Im Falle von führt das zur Bildung von nach der Reaktionsgleichung:[1]
Auch mit Arsenpentafluorid zeigt sich dieses Verhalten, hier führt es zu .[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e f g h i j k Grundlagen und Hauptgruppenelemente: Band 1: Grundlagen und Hauptgruppenelemente, Walter de Gruyter GmbH & Co KG eingeschränkte Vorschau in der Google-Buchsuche
- ↑ Eintrag zu Sauerstoff-Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2017.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Grundlagen und Hauptgruppenelemente: Band 1: Grundlagen und Hauptgruppenelemente, Walter de Gruyter GmbH & Co KG eingeschränkte Vorschau in der Google-Buchsuche