Strontiumacetat
chemische Verbindung
Strontiumacetat ist das Strontiumsalz der Essigsäure mit der Konstitutionsformel Sr(CH3COO)2.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
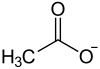
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumacetat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H6SrO4 | |||||||||||||||
| Kurzbeschreibung |
farblose hygroskopische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse |
| |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,1 g·cm−3[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Herstellung
BearbeitenStrontiumacetat kann durch Reaktion von Strontiumcarbonat oder Strontiumhydroxid mit Essigsäure dargestellt werden.
Eigenschaften
BearbeitenStrontiumacetat kristallisiert in der Kälte als Tetrahydrat, bei Raumtemperatur als Hemihydrat.[3]
Strontiumacetat zersetzt sich bei ca. 380 °C unter Bildung von Strontiumcarbonat.[6]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu STRONTIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. März 2022.
- ↑ a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-92.
- ↑ a b R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2, Verlag S. Hirzel, 1908, S. 231–232. (Volltext)
- ↑ a b Datenblatt Strontium acetate, 99.995% trace metals basis bei Sigma-Aldrich, abgerufen am 26. Februar 2013 (PDF).
- ↑ V. V. Cole, B. K. Harned, R. Hafkesbring: The Toxicity of Strontium and Calcium. In: Journal of Pharmacology and Experimental Therapeutics. 71, 1941, S. 1–5; Abstract.
- ↑ A. K. Galwey, M. E. Brown: Thermal decomposition of ionic solids. Verlag Elsevier, 1999, ISBN 0-444-82437-5, S. 450. (eingeschränkte Vorschau in der Google-Buchsuche)

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)