Magnesiumsulfit
Magnesiumsulfit ist eine anorganische chemische Verbindung des Magnesiums aus der Gruppe der Sulfite.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
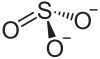
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumsulfit | |||||||||||||||
| Summenformel | MgSO3 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Hexahydrat)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 104,37 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,72 g·cm−3 (Hexahydrat)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenMagnesiumsulfit kann durch Reaktion von Magnesiumhydroxid mit Schwefeldioxid gewonnen werden, wobei bei Temperaturen unter 40 °C das Hexahydrat und darüber das Trihydrat entsteht.[3]
Ebenfalls möglich ist die Darstellung durch Reaktion von Natriumsulfit mit Magnesiumchlorid.[3]
Eigenschaften
BearbeitenMagnesiumsulfit-Hexahydrat hat eine rhomboedrische Kristallstruktur mit Raumgruppe R3 (Raumgruppen-Nr. 146). Das Hexahydrat verliert Kristallwasser ab 78 °C und wandelt sich zum Trihydrat um. Bei 120 °C erfolgt weitere Umsetzung zum Dihydrat und bei 395 °C zum Anhydrat. Das Trihydrat hat eine tetragonale Kristallstruktur mit der Raumgruppe P41212 (Nr. 92), das Dihydrat die monokline Raumgruppe P21/c (Nr. 14).[3]
Entstehung bei der Rauchgasentschwefelung
BearbeitenMagnesiumsulfit entsteht in Systemen zur Rauchgasentschwefelung, in denen Magnesiumhydroxid als Waschalkalie dient (Magnesiumverfahren[4]).[5]
Einzelnachweise
Bearbeiten- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 93rd Edition. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–74 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 143 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ulrich Förstner: Umweltschutztechnik. Springer DE, 2003, ISBN 3-540-44369-X, S. 150 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1461-9, S. 258 (eingeschränkte Vorschau in der Google-Buchsuche).