Lithiumwolframat
Lithiumwolframat ist eine anorganische chemische Verbindung des Lithiums aus der Gruppe der Wolframate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
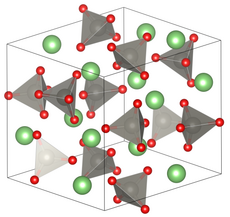
| ||||||||||||||||
| _ Li+ _ Wo6+ _ O2− | ||||||||||||||||
| Kristallsystem |
Trigonal | |||||||||||||||
| Raumgruppe |
R3 (Nr. 148) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumwolframat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Li2WO4 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 261,72 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
3,71 g·cm−3 (25 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenLithiumwolframat kann durch Reaktion von Wolfram(VI)-oxid mit siedender Lösung von Lithiumcarbonat gewonnen werden.[4]
Eigenschaften
BearbeitenLithiumwolframat ist ein hygroskopischer farbloser Feststoff, der löslich in Wasser ist.[2][5] Er kommt in mehreren Modifikationen vor und besitzt bei Raumtemperatur entweder eine Kristallstruktur vom Phenacittyp mit der Raumgruppe R3 (Raumgruppen-Nr. 148).[1] oder eine tetragonale Kristallstruktur die einer verzerrten Spinellstruktur entspricht mit der Raumgruppe I41/amd (Nr. 141).[6] Bei 40 kBar und 850 °C besitzt er eine monokline Kristallstruktur vom Wolframittyp mit der Raumgruppe C2/c (Nr. 15).[7]
Verwendung
BearbeitenLithiumwolframat wird für die Herstellung von Keramiken mit extrem niedrigen Sintertemperaturen eingesetzt. Es dient auch als Katalysator für oxidative Kupplungsreaktionen. Weiterhin wird es zur Herstellung von hochdichten wässrigen Polywolframat (Metawolframat) Lösungen eingesetzt, die zur Trennung von Mineralen und anderen Feststoffen verwendet werden.[2]
Einzelnachweise
Bearbeiten- ↑ a b W. H. Zachariasen, H. A. Plettinger: The crystal structure of lithium tungstate. In: Acta Crystallographica. 14, 1961, S. 229, doi:10.1107/S0365110X61000772.
- ↑ a b c d e Datenblatt Lithiumwolframat bei Alfa Aesar, abgerufen am 5. Juni 2016 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt Lithium tungstate, 98% bei Sigma-Aldrich, abgerufen am 5. Juni 2016 (PDF).
- ↑ R. J. Meyer: Wolfram. Springer-Verlag, 2013, ISBN 978-3-662-13401-6, S. 208 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mohd Rafie Johan, Tan Kim Han, Abdul Kariem Arof: Growth and sintering effects of hydrated polycrystalline Li2WO4. In: Ionics. 16, 2010, S. 323, doi:10.1007/s11581-009-0407-4.
- ↑ Evgeni Tonkov: High Pressure Phase Transformations A Handbook. CRC Press, 1992, ISBN 978-2-88124-759-0, S. 534 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hiroyuki Horiuchi, Nobuo Morimoto, Shinobu Yamaoka: The crystal structure of Li2WO4(IV) and its relation to the wolframite-type structure. In: Journal of Solid State Chemistry. 33, 1980, S. 115, doi:10.1016/0022-4596(80)90554-X.