Elacestrant
Elacestrant ist ein Arzneistoff aus der Gruppe der Antiestrogene. Unter dem Namen Orserdu (Hersteller: Stemline Therapeutics) wurde er im Januar 2023 in den USA zur oralen Behandlung bestimmter Formen von Brustkrebs zugelassen. Im September 2023 folgte die Zulassung in der EU.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
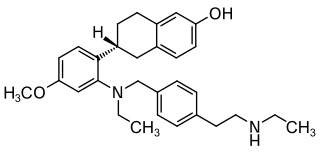
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Elacestrant[1] | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C30H38N2O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 458,63 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Eigenschaften
BearbeitenElacestrant ist eine niedermolekulare nichtsteroidale Verbindung und wirkt als selektiver Estrogenrezeptor-Downregulator (SERD). Er bindet antagonistisch an den Estrogenrezeptor-alpha (ERα), wodurch nachgeschaltete Signalwege unterdrückt und ein beschleunigter Abbau des ERα induziert werden.[3][4]
Elacestrant wird pharmazeutisch in Form seines Hydrochlorids, Elacestrantdihydrochlorid,[5] angewendet. Elacestrantdihydrochlorid ist ein weißer bis fast weißer oder grauer Feststoff und leicht löslich in 0,01 N Salzsäure.[6] Das Molekül hat ein chirales Zentrum und liegt in der R-Konfiguration vor.
Verwendung
BearbeitenDie Food and Drug Administration (FDA) erteilte im Januar 2023 in den USA die Zulassung für die Behandlung von postmenopausalen Frauen oder erwachsenen Männern mit ER-positivem, HER2-negativem, ESR1-mutiertem fortgeschrittenem oder metastasiertem Brustkrebs mit Krankheitsprogression für die Zweit- oder Mehrlinientherapie (nach mindestens einer Linie endokriner Therapie). Die europäische Kommission ließ Orserdu im September 2023 zu.[7]
Elacestrant ist zum Einnehmen geeignet. Durch die Verabreichungsart (Tablette) unterscheidet sich Elacestrant vom ersten zugelassenen Wirkstoff aus der Gruppe der SERD, Fulvestrant (Faslodex von AstraZeneca), aufgrund seiner besseren oralen Bioverfügbarkeit. Hingegen muss Fulvestrant injiziert werden.
Pharmakokinetik
BearbeitenDie Bioverfügbarkeit nach oraler Gabe beträgt ca. 10 %. Maximale Plasmaspiegel werden nach 1 bis 4 Stunden erreicht. In Kombination mit fettreicher Mahlzeit waren die maximalen Plasmaspiegel und die Bioverfügbarkeit erhöht. Elacestrant bindet unabhängig von seiner Konzentration zu über 99 % an Plasmaproteine. Die Eliminationshalbwertszeit liegt bei 30 bis 50 Stunden. Die Biotransformation erfolgt hauptsächlich über CYP3A4. Die Ausscheidung findet größtenteils (82 %) über die Faezes statt und zum kleineren Teil (7 %) über den Urin.[6]
Nebenwirkungen und Anwendungsbeschränkungen
BearbeitenDie häufigsten unerwünschten Wirkungen waren Schmerzen des Muskel-Skelett-Systems, Übelkeit, Müdigkeit, Erbrechen, verminderter Appetit, Durchfall, Kopfschmerzen, Verstopfung, Bauchschmerzen, Hitzewallungen und Dyspepsie. Bei den Laborwerten wurden erhöhtes Cholesterin, erhöhte AST, erhöhte ALT, erhöhte Triglyceride, erhöhtes Kreatinin sowie vermindertes Hämoglobin (roter Blutfarbstoff) und vermindertes Natrium beobachtet.[6]
Aufgrund des Wirkmechanismus besteht bei der Anwendung von Elacestrant in der Schwangerschaft das Risiko für eine Fruchtschädigung. In Versuchen an trächtigen Ratten traten auch unterhalb therapeutischer Dosen Fehlbildungen oder Absterben der Embryos bzw. Feten auf. Frauen im fortpflanzungsfähigen Alter und männliche Patienten mit Partnerinnen im fortpflanzungsfähigen Alter müssen eine wirksame Empfängnisverhütung praktizieren.[6]
Klinische Prüfung
BearbeitenDie Zulassung durch die FDA stützt sich auf Ergebnisse aus der EMERALD-Studie.[8] In diese randomisierte, offene und kontrollierte Studie wurden 478 postmenopausale Frauen und Männer mit ER-positivem, HER2-negativem fortgeschrittenem oder metastasierendem Brustkrebs aufgenommen, die zuvor mindestens eine endokrine Therapie einschließlich einer Vorbehandlung mit einem CDK4/6-Inhibitor erhalten hatten. 228 Patienten wiesen ESR1-Mutationen auf.
Die Patienten erhielten randomisiert Elacestrant (1× täglich) oder eine endokrine Standard-of-Care-Therapie (SOC), hier Fulvestrant oder einen Aromatasehemmer. Primärer Endpunkt war das progressionsfreie Überleben (progression-free survival, PFS), das anhand von Bildgebung unabhängig und verblindet bewertet wurde.
Es wurde ein statistisch signifikanter Unterschied im progressionsfreien Überleben in der Intention-to-treat-Population (ITT) und in der Untergruppe mit ESR1-Mutationen beobachtet. Bei den 228 Patienten mit ESR1-Mutationen betrug das mediane PFS 3,8 Monate in der Elacestrant-Gruppe und 1,9 Monate in der SOC-Gruppe (Fulvestrant oder Aromatasehemmer).[4]
Einzelnachweise
Bearbeiten- ↑ INN Recommended List 77, World Health Organisation (WHO), 9. März 2017.
- ↑ a b Safety Data Sheet. GLPBIO, abgerufen am 7. Februar 2023.
- ↑ Maxwell R. Lloyd, Seth A. Wander, Erika Hamilton, Pedram Razavi, Aditya Bardia: Next-generation selective estrogen receptor degraders and other novel endocrine therapies for management of metastatic hormone receptor-positive breast cancer: current and emerging role. In: Therapeutic Advances in Medical Oncology. 2022, Band 14, S. 175883592211136, DOI:10.1177/17588359221113694.
- ↑ a b François-Clément Bidard, Virginia G. Kaklamani, Patrick Neven, Guillermo Streich, Alberto J. Montero, Frédéric Forget, Marie-Ange Mouret-Reynier, Joo Hyun Sohn, Donatienne Taylor, Kathleen K. Harnden, Hung T. Khong, Judit Kocsis, Florence Dalenc, Patrick M. Dillon, Sunil G. Babu, Simon Waters, Ines Deleu, José Darío Sáenz, Emilio Bria, Marina Elena Cazzaniga, Janice Lu, Philippe Aftimos, Javier Cortes, Shubin Liu, Giulia Tonini, D. Laurent, Nassir Habboubi, Maureen G. Conlan, Aditya Bardia: Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor–Positive, Human Epidermal Growth Factor Receptor 2–Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. In: Journal of Clinical Oncology. 2022, Band 40, Nummer 28, S. 3246–3256, DOI:10.1200/JCO.22.00338.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Elacestrantdihydrochlorid: CAS-Nummer: 1349723-93-8, PubChem: 67479909, ChemSpider: 57583806, Wikidata: Q27270799.
- ↑ a b c d Oserdu, Prescibing Information, Stemline Therapeutics Inc., Januar 2023.
- ↑ Eintrag EU/1/23/1757. In: ec.europa.eu. Abgerufen am 7. Oktober 2023.
- ↑ FDA approves elacestrant for ER-positive, HER2-negative, ESR1-mutated advanced or metastatic breast cancer, FDA, 27. Januar 2023.