Diazoaminobenzol
Diazoaminobenzol ist ein mit zwei Phenylgruppen substituiertes Triazen. Es ist ein Isomeres von Anilingelb, bei dessen Synthese es bei der Wahl ungeeigneter Reaktionsbedingungen (pH-Wert und Temperatur bei der Azokupplung) anstelle dessen entsteht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
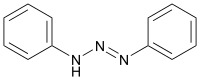
| |||||||||||||||||||
| (E)-Isomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Diazoaminobenzol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H11N3 | ||||||||||||||||||
| Kurzbeschreibung |
gelbbrauner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 197,24 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
146 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte Bearbeiten
Im Jahre 1860 beschrieb Peter Griess[5] eine Substanz, die er durch Einwirken von Salpetriger Säure auf eine alkoholische Anilinlösung erhielt. 1863[6] publizierte er eine Methode diesen Stoff durch Einleiten nitroser Gase in eine ethanolische Lösung von „salpetersaurem Anilin“ (Salz der Salpetersäure und Anilin) bis zur Abscheidung nadelförmiger „Krystalle“ zu erhalten. Genauere Versuchsbeschreibungen finden sich in der Publikation Über eine neue Classe organischer Verbindungen, in denen Wasserstoff durch Stickstoff vertreten ist.[7] Hier berichtet er, dass die Verbindung in Form weißer Kristalle, die gut in Wasser, aber nicht in Ether oder Alkohol löslich sind, entsteht. Er berichtet dabei aber auch, dass durch Wärme oder Erschütterung die Verbindung heftig explodiert. Dies ist der erste Hinweis auf die Synthese von 1,3-Diphenyltriazen.
Gewinnung und Darstellung Bearbeiten
Diazoaminobenzol wird durch Diazotierung von Anilin und Kupplung auf undiazotiertes Anilin bei pH-Werten > 9 hergestellt.[8]
Eigenschaften Bearbeiten
Diazoaminobenzol ist ein gelb-braunes, feinkristallines Pulver. Es ist empfindlich gegen Licht, Schlag, Reibung und Stoß (Explosionsgefahr). Beim Erhitzen über den Siedepunkt und bei Belichtung spaltet es Stickstoff ab. Konkret hier ist mit einer unkontrollierten, explosionsartigen Zersetzung zu rechnen.[1] Die mittels DSC bestimmte Zersetzungswärme beträgt −266 kJ·mol−1 bzw. −1348 kJ·kg−1.[9] Bei der Einwirkung von Säuren lagert es sich in 4-Aminoazobenzol (Anilingelb) um.
Chemische Eigenschaften Bearbeiten
Triazene können tautomerisieren, im Falle des Diazoaminobenzol sind die beiden tautomeren Formen identisch. Die –N=N–Doppelbindung zeigt die übliche (EZ)-Isomerie. Das stabilere Isomere ist (E)-Diazoaminobenzol, über das weniger stabilere (Z)-Diazoaminobenzol wurden keine Daten in der Literatur gefunden.
Verwendung Bearbeiten
Diazoaminobenzol findet/fand Verwendung als Insektizid und als Kunststoff-Additiv. In der metallorganischen Chemie wird es als Ligand (=Komplexbildner) verwendet. Als Verunreinigung kommt es in Farbstoffen, Kosmetika und Pharmazeutika vor.[10][11]
Sicherheitshinweise Bearbeiten
Diazoaminobenzol steht unter dem Verdacht, carcinogen zu sein. Es wird im Organismus zu den als carcinogen eingestuften Stoffen Benzol und Anilin metabolisiert. Weiterhin zeigt es auch mutagene Eigenschaften.[11]
Nachweis Bearbeiten
Der Nachweis kann mittels Dünnschichtchromatographie oder per HPLC erfolgen.
Literatur Bearbeiten
- Helv. Chim. Acta. 63, 1980, S. 456–472
- Beilstein. EIV 16, S. 904
- Helv. Chim. Acta. 64, 1981, S. 174–175
- Merck-Index (10), Nr. 2970
- Ullmann. 5, S. 802
Einzelnachweise Bearbeiten
- ↑ a b c d Datenblatt Diazoaminobenzol bei Merck, abgerufen am 18. Januar 2011.
- ↑ Eintrag zu 1,3-Diphenyl-1-triazene in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 20. November 2022. (Seite nicht mehr abrufbar)
- ↑ Eintrag zu 1,3-Diphenyltriazen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. September 2011.
- ↑ a b Datenblatt 1,3-Diphenyltriazene bei Sigma-Aldrich, abgerufen am 23. Mai 2017 (PDF).
- ↑ P. Griess: Annalen der Chemie und Pharmacie CXIII (1860). S. 337.
- ↑ P. Griess: Centralblatt (1863). S. 125.
- ↑ P. Griess: Centralblatt Nr. 7 11. Jahrg. (1866). S. 1.
- ↑ Hartman, W. W.; Dickey, J. B.: Diazoaminobenzene In: Organic Syntheses. 14, 1934, S. 24, doi:10.15227/orgsyn.014.0024; Coll. Vol. 2, 1943, S. 163 (PDF).
- ↑ Grewer, T.; Klais, O.: Exotherme Zersetzung - Untersuchungen der charakteristischen Stoffeigenschaften, VDI-Verlag, Schriftenreihe „Humanisierung des Arbeitslebens“, Band 84, Düsseldorf 1988, ISBN 3-18-400855-X, S. 9.
- ↑ Eintrag zu 1,3-Diphenyl-1-Triazene in der Hazardous Substances Data Bank (via PubChem), abgerufen am 18. November 2014.
- ↑ a b National Institute of Environmental Health Sciences, 13th Report on Carcinogens (RoC): Diazoaminobenzene, abgerufen am 18. November 2014.
