Cyclen
Cyclen, beziehungsweise 1,4,7,10-Tetraazacyclododecan, ist ein cyclisches Polyamin. Cyclen ist der Ausgangsstoff für DOTA und DOTA-Derivate, die eine breite Anwendung als Arzneistoffe haben.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
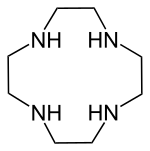
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Cyclen | ||||||||||||||||||
| Andere Namen |
1,4,7,10-Tetraazacyclododecan | ||||||||||||||||||
| Summenformel | C8H20N4 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 172,27 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Synthese
BearbeitenCyclen kann durch die Kombination von zwei nukleophilen Substitutions-Reaktionen hergestellt werden. Mit der zuerst 1974 von Richman und Atkins[5] beschriebenen Synthese lassen sich auch viele verwandte makrocyclische Polyazaalkane herstellen.
Ausgangsprodukt ist dabei Diethylentriamin (1), das mit 3 Äquivalenten Tosylchlorid in Pyridin zu (3) umgesetzt wird. In Natriumethanolat wird je ein Proton der beiden primären Amine des Diethylentriamin abgespalten und durch Natrium-Ionen ersetzt (4). Als zweite Ausgangsverbindung wird Diethanolamin (2) eingesetzt. Es wird ebenfalls mit 3 Äquivalenten Tosylchlorid zu (5) umgesetzt. Beide Verbindungen (4) und (5) werden in Dimethylformamid in großer Verdünnung zur Reaktion gebracht um eine Polymerisation zu langen Ketten zu vermeiden. Im letzten Schritt werden die Tosyl-Gruppen mit Schwefelsäure entfernt und das Cyclen (7) wird erhalten. Das Rohprodukt ist meistens durch Verunreinigungen leicht gelblich gefärbt. Durch Sublimation kann Cyclen sehr rein als weißer Feststoff erhalten werden.
Verwendung
BearbeitenCyclen hat ausgezeichnete Komplexierungseigenschaften. So werden ähnlich den Kronenethern selektiv Kationen gebunden.
Ein großer Teil des Cyclens wird technisch weiterverarbeitet und mit Bromessigsäure umgesetzt um DOTA beziehungsweise DOTA-Derivate zu erhalten. Da die Stickstoffatome im Gegensatz zu den Sauerstoffatomen der Kronenether eine weitere Bindung zulassen, werden, ähnlich dem DOTA, auch (mehrere) größere Reste, wie z. B. Adenosin, angekoppelt um neue Eigenschaften zu erhalten. Diese sehr starken Komplexbildner werden sowohl in der Diagnostik, als auch in der Therapie vielfältig eingesetzt.
Literatur
Bearbeiten- C. Wängler, B. Wängler, M. Eisenhut, U. Haberkorn, W. Mier: Improved syntheses and applicability of different DOTA building blocks for multiply derivatized scaffolds, in: Bioorganic & Medicinal Chemistry, 2008, 16 (5), S. 2606–2016; PMID 18065226.
- R. Delgado, V. Félix, L. M. Lima, D. W. Price: Metal complexes of cyclen and cyclam derivatives useful for medical applications: a discussion based on thermodynamic stability constants and structural data, in: J. Chem. Soc., Dalton Trans., 2007, 26, S. 2734–2745; PMID 17592589.
- Julien Massue, Sally E. Plush, Célia S. Bonnet, Doireann A. Moore and Thorfinnur Gunnlaugsson: Selective mono N-alkylations of cyclen in one step syntheses, in: Tetrahedron Letters, 2007, 48, S. 8052–8055; doi:10.1016/j.tetlet.2007.09.022.
- X. Y. Tan, J. Zhang, Y. Huang, Y. Zhang, L. H. Zhou, N. Jiang, H. H. Lin, N. Wang, C. Q. Xia, X. Q. Yu: Synthesis and DNA-cleavage properties of metal complexes of 1,4,7,10-tetraazacyclododecane (cyclen) functionalized with a pendant benzocrown ether, in: Chem. Biodivers., 2007 4 (9), S. 2190–2197; PMID 17886837.
- E. Delgado-Pinar, J. C. Frías, L. J. Jiménez-Borreguero, M. T. Albelda, J. Alarcón, E. García-España: One-pot preparation of surface modified boehmite nanoparticles with rare-earth cyclen complexes, in: Chem. Commun. (Camb.), 2007, 32, S. 3392–3394; PMID 18019508.
- K. E. Borbas, J. I. Bruce: Synthesis of asymmetrically substituted cyclen-based ligands for the controlled sensitisation of lanthanides, in: Org. Biomol. Chem., 2007, 5, S. 2274–2282; PMID 17609759.
- Katell Sénéchal-David, Simon J. A. Pope, Susan Quinn, Stephen Faulkner, Thorfinnur Gunnlaugsson: Sensitized Near-Infrared Lanthanide Luminescence from Nd(III)- and Yb(III)-Based Cyclen-Ruthenium Coordination Conjugates, in: Inorg. Chem., 2006, 45 (25), S. 10040–10042; doi:10.1021/ic061706i.
Einzelnachweise
Bearbeiten- ↑ a b Datenblatt 1,4,7,10-Tetraazacyclododecane (PDF) bei Strem, abgerufen am 25. Dezember 2012.
- ↑ Datenblatt Cyclen bei Sigma-Aldrich, abgerufen am 23. März 2011 (PDF).
- ↑ a b Eintrag zu 1,4,7,10-Tetraazacyclododecan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu 1,4,7,10-Tetraazacyclododecan im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ J. E. Richman, T. J. Atkins: Nitrogen analogs of crown ethers, in: J. Am. Chem. Soc., 96, 1974, S. 2268–2270; doi:10.1021/ja00814a056.


