Cyanidin-3-O-sambubiosid
Cyanidin-3-O-sambubiosid ist ein Anthocyan aus Sambubiose und dem Aglycon Cyanidin. Die Grundstruktur ist das Flavylium-Kation. Es ist unter anderem ein wichtiges Anthocyan des schwarzen Holunders.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
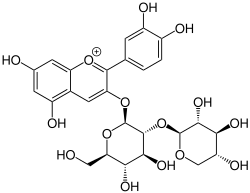
| ||||||||||
| Strukturformel des Kations. Gegenion ist nicht abgebildet | ||||||||||
| Allgemeines | ||||||||||
| Name | Cyanidin-3-O-sambubiosidchlorid | |||||||||
| Summenformel | C26H29O15Cl | |||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 616,95 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Es ist nicht genau bekannt, welche die Gegenionen kationischer Anthocyanine in Pflanzen sind (vermutlich handelt es sich um organische Anionen), isoliert werden sie aber meist als Chloride.[3] Daher sind in der nebenstehenden Infobox Daten zu Cyanidin-3-O-sambubiosidchlorid angegeben.
Vorkommen Bearbeiten
Cyanidin-3-O-sambubiosid ist eines der mengenmäßig wichtigsten Anthocyane im schwarzen Holunder (Sambucus nigra)[4][5], kommt aber auch in anderen Arten der Gattung Sambucus vor, darunter Sambucus javanica, dem Roten Holunder (Sambucus racemosa), Sambucus cerulea und Sambucus ebulus.[6] Außerdem kommt es vor in der Roselle[7], Maquibeeren (Aristotelia chilensis)[8][9], in schwarzen Erdnüssen[10], sowie in verschiedenen Arten der Gattungen Cotyledon und Tylecodon.[11]
Nachweis Bearbeiten
Die Verbindung kann durch Ultra-High-Performance-Flüssigchromatographie kombiniert mit Infrarotspektroskopie und Massenspektrometrie nachgewiesen werden.[12]
Einzelnachweise Bearbeiten
- ↑ LGC Standards: Cyanidin-3-O-Sambubioside Chloride (AS) | LGC Standards, abgerufen am 28. Juli 2023
- ↑ a b c Datenblatt Cyanidin 3-sambubioside chloride bei Sigma-Aldrich, abgerufen am 28. Juli 2023 (PDF).
- ↑ Raymond Brouillard: The in vivo expression of anthocyanin colour in plants. In: Phytochemistry. Band 22, Nr. 6, Januar 1983, S. 1311–1323, doi:10.1016/S0031-9422(00)84008-X (elsevier.com [abgerufen am 9. August 2023]).
- ↑ R Veberic, J Jakopic, F Stampar, V Schmitzer: European elderberry (Sambucus nigra L.) rich in sugars, organic acids, anthocyanins and selected polyphenols. In: Food Chemistry. Band 114, Nr. 2, 15. Mai 2009, S. 511–515, doi:10.1016/j.foodchem.2008.09.080.
- ↑ V. I. Deineka, V. N. Sorokopudov, L. A. Deineka, E. I. Shaposhnik, S. V. Kol’tsov: Anthocyans from Fruit of Some Plants of the Caprifoliaceae Family. In: Chemistry of Natural Compounds. Band 41, Nr. 2, März 2005, S. 162–164, doi:10.1007/s10600-005-0102-2.
- ↑ Maja Mikulic-Petkovsek, Valentina Schmitzer, Ana Slatnar et al.: Investigation of Anthocyanin Profile of Four Elderberry Species and Interspecific Hybrids. In: Journal of Agricultural and Food Chemistry. Band 62, Nr. 24, 18. Juni 2014, S. 5573–5580, doi:10.1021/jf5011947.
- ↑ Thomas Frank, Marlies Janßen, Michael Netzel, Gabriele Straß, Adolf Kler, Erwin Kriesl, Irmgard Bitsch: Pharmacokinetics of Anthocyanidin-3-Glycosides Following Consumption of Hibiscus sabdariffa L. Extract. In: The Journal of Clinical Pharmacology. Band 45, Nr. 2, Februar 2005, S. 203–210, doi:10.1177/0091270004270561.
- ↑ María Teresa Escribano-Bailón, Cristina Alcalde-Eon, Orlando Muñoz, Julián C. Rivas-Gonzalo, Celestino Santos-Buelga: Anthocyanins in berries of Maqui [Aristotelia chilensis (Mol.) Stuntz]. In: Phytochemical Analysis. Band 17, Nr. 1, Januar 2006, S. 8–14, doi:10.1002/pca.872.
- ↑ Carlos L. Céspedes, Maribel Valdez-Morales, José G. Avila, Mohammed El-Hafidi, Julio Alarcón, Octavio Paredes-López: Phytochemical profile and the antioxidant activity of Chilean wild black-berry fruits, Aristotelia chilensis (Mol) Stuntz (Elaeocarpaceae). In: Food Chemistry. Band 119, Nr. 3, 1. April 2010, S. 886–895, doi:10.1016/j.foodchem.2009.07.045.
- ↑ Kaikai Li, Mengying Zhang, Haoze Chen, Jinming Peng, Fan Jiang, Xin Shi, Yilin Bai, Min Jian, Yangyang Jia: Anthocyanins from black peanut skin protect against UV-B induced keratinocyte cell and skin oxidative damage through activating Nrf 2 signaling. In: Food & Function. Band 10, Nr. 10, 2019, S. 6815–6828, doi:10.1039/C9FO00706G.
- ↑ Ben-Erik Van Wyk, Pieter J.D. Winter: The homology of red flower colour in Crassula, cotyledon and Tylecodon (Crassulaceae). In: Biochemical Systematics and Ecology. Band 23, Nr. 3, April 1995, S. 291–293, doi:10.1016/0305-1978(95)00004-E.
- ↑ Stefan Stuppner, Sophia Mayr, Anel Beganovic, Krzysztof Beć, Justyna Grabska, Urban Aufschnaiter, Magdalena Groeneveld, Matthias Rainer, Thomas Jakschitz, Günther K. Bonn, Christian W. Huck: Near-Infrared Spectroscopy as a Rapid Screening Method for the Determination of Total Anthocyanin Content in Sambucus Fructus. In: Sensors. Band 20, Nr. 17, 2. September 2020, S. 4983, doi:10.3390/s20174983, PMID 32887485, PMC 7506738 (freier Volltext).