Blei(II)-arsenat
Blei(II)-arsenat ist eine anorganische chemische Verbindung des Bleis aus der Gruppe der Arsenate.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
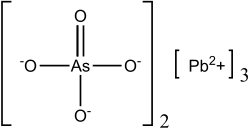
| ||||||||||||||||
| Raumgruppe |
P21/c (Nr. 14) | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Blei(II)-arsenat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Pb3(AsO4)2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 899,41 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | |||||||||||||||
| MAK |
Schweiz: 0,1 mg·m−3 (bezogen auf Arsen/Blei, gemessen als einatembarer Staub)[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Vorkommen
BearbeitenBlei(II)-arsenat kommt in komplexen Rohstoffen für die Herstellung von Kupfer, Blei und einer Reihe von Edelmetallen vor. Es wird im metallurgischen Veredelungsprozess in Calciumarsenat und Diarsentrioxid umgewandelt.[7]
Eigenschaften
BearbeitenBlei(II)-arsenat ist ein weißer Feststoff, der wenig löslich in Wasser ist. Er zersetzt sich bei Erhitzung über 1042 °C, wobei Arsen, Arsenoxide, und Bleiverbindungen entstehen.[1] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14).[8] Es existiert noch eine Hochtemperaturmodifikation mit der Raumgruppe P63/m (Nr. 176).[2]
Gewinnung und Darstellung
BearbeitenBleiarsenat kann durch Reaktion von Bleiacetat oder Bleinitrat mit Natriumarsenat gewonnen werden.
Verwendung
BearbeitenSicherheitshinweise
BearbeitenBlei(II)-arsenat steht auf Grund seiner karzinogenen und reproduktionstoxischen Eigenschaften auf der Liste der besonders besorgniserregenden Stoffe.
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Blei(II)-arsenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ a b R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 656 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, 2015, ISBN 978-1-4822-6097-7, S. 70 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter die Gruppeneinträge zu lead compounds with the exception of those specified elsewhere in this Annex und arsenic acid and its salts with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 18. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. Oktober 2015.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 3687-31-8 bzw. Blei(II)-arsenat), abgerufen am 24. Oktober 2016.
- ↑ REACH: REACH-CLP-Biozid Helpdesk - Informationen zum Kandidatenstoff / Bundesstelle Chemikalien/Zulassung Biozide / Bundesanstalt für Arbeitsschutz und Arbeitsmedizin ( vom 24. September 2015 im Internet Archive), abgerufen am 5. September 2015
- ↑ K. Viswanathan, G. Miehe: The crystal structure of low temperature Pb(AsO). In: Zeitschrift für Kristallographie. 148, 1978, S. 275, doi:10.1524/zkri.1978.148.3-4.275.
- ↑ Michael C. Newman, Michael A. Unger: Fundamentals of Ecotoxicology, Second Edition. CRC Press, 2002, ISBN 978-1-56670-598-1, S. 28 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Percival J. Fryer: Insect Pests and Fungus Diseases of Fruit and Hops. Cambridge University Press, 2015, ISBN 978-1-107-54455-0, S. 403 (eingeschränkte Vorschau in der Google-Buchsuche).


