Bismutsubbromid
chemische Verbindung
Bismutsubbromid ist eine chemische Verbindung aus der Gruppe der Bromide. Neben diesem sind mit Bismut(I)-bromid und Bismut(III)-bromid zwei weitere Bismutbromide bekannt.[3][4]
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
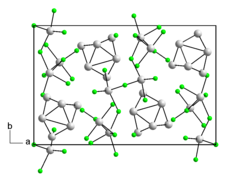
| |||||||
| _ Bi _ Br | |||||||
| Allgemeines | |||||||
| Name | Bismutsubbromid | ||||||
| Andere Namen |
Dodecabismuttetradecabromid | ||||||
| Verhältnisformel | Bi6Br7 | ||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 1813,25 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Dichte |
7,25 g·cm−3[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Gewinnung und Darstellung
BearbeitenBismutsubbromid kann durch Reaktion von Bismut mit Bismut(III)-bromid bei 272 °C gewonnen werden. Die Verbindung wurde zuerst 1978 von Heike von Benda synthetisiert.[1][5]
Eigenschaften
BearbeitenBismutsubbromid ist ein schwarzer Feststoff mit nadelförmigen Kristallen. Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pnnm (Raumgruppen-Nr. 58).[1]
Einzelnachweise
Bearbeiten- ↑ a b c d e Matthias F. Groh, Ulrike Müller, Ejaz Ahmed, Alexander Rothenberger, Michael Ruck: Substitution of Conventional High-temperature Syntheses of Inorganic Compounds by Near-room-temperature Syntheses in Ionic Liquids. In: Zeitschrift für Naturforschung B. 68, 2013, doi:10.5560/ZNB.2013-3141.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ R.A. Mackay, W. Henderson: Introduction to Modern Inorganic Chemistry, 6th edition. CRC Press, 2002, ISBN 978-0-7487-6420-4, S. 469 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Daniel Cubicciotti: Thermodynamic properties of bismuth(I) bromide and bismuth(III) bromide. In: Inorganic Chemistry. 7, 1968, S. 208, doi:10.1021/ic50060a005.
- ↑ Heike von Benda, Arndt Simon, Wolfgang Bauhofer: Zur Kenntnis von BiBr und BiBr1,167. In: Zeitschrift für anorganische und allgemeine Chemie. 438, 1978, S. 53, doi:10.1002/zaac.19784380105.