| Sulfonsäuren und ihre Derivate |
|---|
 Sulfonsäure |
 Sulfonsäureester |
 Sulfonsäuresalze |
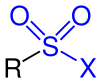 Sulfonsäurehalogenide |
 Sulfonsäureamide |
| R, R1, R2 und R3 sind Organylgruppen. Die funktionellen Gruppen sind blau markiert. |
Sulfonsäuren sind organische Schwefelverbindungen mit der allgemeinen Struktur R–SO2–OH, wobei R ein organischer Rest ist. Ihre Salze und Ester mit der allgemeinen Struktur R–SO2–O- und R1–SO2–O–R2 heißen Sulfonate.
Sulfonsäuren und ihr zugehörigen Salze und Ester werden in zwei Gruppen eingeteilt: die aliphatischen Sulfonsäuren bzw. Alkansulfonsäuren oder -sulfonate und die aromatischen Sulfonsäuren bzw. Arensulfonsäuren oder -sulfonate.
Gewinnung und Darstellung Bearbeiten
Für die technische Herstellung der Sulfonsäuren gibt es mehrer Möglichkeiten, welche hier beispielhaft dargestellt sind.[1]
Ein Gemisch aus Alkansulfonsäuren entsteht durch die Einwirkung von Schwefeldioxid und Sauerstoff auf höhere Alkane in Gegenwart von Radikalbildnern.
Des Weiteren können aliphatische Sulfonsäuren durch die Oxidation von Thiolen synthetisiert werden.
Durch nucleophile Substition werden aus Halogenalkanen und Natriumsulfit Natriumsalze der entsprechenden Sulfonsäure dargestellt.
Arensulfonsäuren werden durch die Sulfonierung von Arenen hergestellt. Es findet eine elektrophile aromatische Substitution statt. Das elektrophile Reagens Schwefeltrioxid liegt in konzentrierter Schwefelsäure im Gleichgewicht vor.
Verwendung und Vorkommen Bearbeiten
Eine spezielle Anwendung finden polymere Sulfonsäuren bei der Wasseraufbereitung, wo sie in Ionenaustauschern für Kationen eingesetzt werden. Alkylbenzolsulfonate, wie Dodecylbenzolsulfonat, werden in Kläranlagen durch Mikroorganismen abgebaut. Des Weiteren sind Sulfonsäuren und ihre Derivate in Gerbstoffen und Arzneimitteln enthalten.[1] Auch viele Farbstoffe enthalten Sulfonatgruppen.
Die Natriumsalze der Sulfonsäuren werden oft als anionische Tenside in Reinigungsmittel eingesetzt.[2] Von diesen Alkylbenzolsulfunate (ABS) mit der allgemeinen Formel CnH2n+1–C6H4–SO3− Na+ war der wichtigste Vertreter bis in die 1960er-Jahre das Tetrapropylenbenzolsulfonat (TBS). Es hatte in den 1950er-Jahren die Seife als Tensid weitgehend verdrängt. Jedoch fand man heraus, dass TBS (wie viele Vertreter der stark verzweigten ABS) im Abwasser nur schlecht abgebaut werden kann und es wurde deshalb ab 1964 durch sogenannte lineare Alkylbenzolsulfonate (LAS) abgelöst, die seit Jahren die wichtigsten Tenside in der Waschmittelchemie sind. Praktisch handelt es sich jedoch weniger um lineare, sondern eher um sekundäre Alkylbenzolsulfonate. Ein linearer Alkylbenzolsulfonat ist z. B Natriumdodecylbenzolsulfonat.
-
Tetrapropylenbenzolsulfonat (TBS)
-
Natriumdodecylbenzolsulfonat, Beispiel aus dem Isomerengemisch.
-
Taurin, eine der wenigen natürlich vorkommenden Aminosulfonsäuren.
-
p-Toluolsulfonsäureist ein wichtiges Reagenz in der organischen Synthese.
-
Nafion wird als Membran in Brennstoffzellen verwendet.
Eigenschaften Bearbeiten
Alkansulfonsäuren sind im allgemeinen viskose Flüssigkeiten, wobei die Arensulfonsäuren hygroskopische Kristalle bilden. Diese lösen sich leicht in Wasser und können durch Natriumchlorid ausgesalzen werden. Einige Sulfonsäuren bilden stabile, kristalline Hydrate.[1] Einfache Alkansulfonsäuren wie z. B. dieMethansulfonsäure sind farblose Flüssigkeiten.
Im Gegensatz zu den Estern der Schwefelsäure liegen hier R–S- und nicht R–O–S-Bindungen vor. Sie unterscheiden sich auch von den Sulfonen (R–SO2–R'), die über keine Hydroxygruppe verfügen. Sulfonsäuren sind stärkere Säuren als Carbonsäuren, weil die Sulfongruppe einen stärkeren elektronenziehenden Effekt auf die Hydroxygruppe ausübt als die Carbonylgruppe, und das Proton damit leichter übertragen wird. Triflourmethansulfonsäure ist sogar stärker als Perchlorsäure und gehört damit zu der Gruppe der Supersäuren.[3]
Reaktionen Bearbeiten
Nucleophile Substitution Bearbeiten
Arensulfonate können bei Temperaturen von 200 bis 300 °C durch eine nucleophile Substitution in Amine, Phenole, Carbonsäuren oder Nitrile umgewandelt werden.[1]
Salzbildung Bearbeiten
Wie oben schon erwähnt, sind Sulfonsäuren ähnlich wie Schwefelsäure starke Säuren, die mit Metallhydroxiden Salze bilden. Im Gegensatz zu den entsprechenden Sulfaten (Salze der Schwefelsäure) lösen sich aber Calcium- Barium- und Blei(II)-sulfonate gut in Wasser.[1]
Desulfonierung von Arensulfonsäuren Bearbeiten
Die Sulfonierung von Arenen zur Herstellung von Arensulfonsäuren ist eine reversible Reaktion. Die bei der Herstellung angegebene Benzolsulfonsäure wird beispielsweise durch verdünnte Salzsäure bei Temperaturen von 150 bis 200 °C zu Benzol hydrolysiert:[1]
Siehe auch Bearbeiten
Sulfonylgruppe (hier sind beide organischen Reste direkt an den Schwefel gebunden) Organoschwefelverbindungen
Einzelnachweise Bearbeiten
- ↑ a b c d e f Siegfried Hauptmann: Organische Chemie. Deutscher Verlag für Grundstoffindustrie, 1985, ISBN 3-87144-902-4, S. 480–487.
- ↑ Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 97, ISBN 978-3-11-024894-4.
- ↑ Hans Beyer: Lehrbuch der Organischen Chemie. S. Hirzer Verlag, 1998, ISBN 3-7776-0808-4, S. 158–160.
[[Kategorie:Stoffgruppe]]
[[Kategorie:Sulfonsäure| ]]