Barettin
Barettin ist ein natürliches bromiertes Alkaloid.[2] Chemisch betrachtet enthält Barrettin ein Diketopiperazin-Grundgerüst, das aus der Aminosäure Arginin und einem bromierten Tryptophan-Derivat mit einer zusätzlichen Doppelbindung, besteht.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
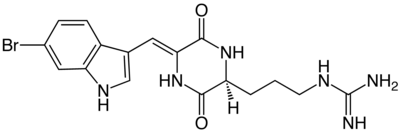
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Barettin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C17H19BrN6O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 419,28 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Vorkommen und Entdeckung
BearbeitenBarettin wurde erstmals 1986 von Lidgren und Bohlin aus dem Meeresschwamm Geodia barretti Bowerbank 1858 isoliert.[3] Sie gaben der Verbindung den vom Schwamm abgeleiteten Namen, jedoch wurde die von ihnen postulierte Struktur 1987 von Lieberknecht und Griesser durch Synthese widerlegt.[4] Die tatsächliche Struktur von Barettin wurde erst 2002 von Sölter et al. aufgeklärt.[5]
Funktion
BearbeitenBrom-substituierte Tryptophan-Derivate sind bei marinen Schwämmen und anderen marinen wirbellosen Tieren nicht außergewöhnlich. Bei Geodia barretti erfüllen diese Brom-substituierten Aminosäuren die Funktion, den Lebensraum, beispielsweise gegen Seepocken, abzusichern. In der Umgebung der Schwämme wurden Konzentrationen von Barettin im Meerwasser gemessen, die eine Ansiedlung von Seepocken verhindern.[6]
Wirkung im menschlichen Körper
BearbeitenDie Wirkungsweise im menschlichen Körper ist bisher noch weitgehend unklar, jedoch zeigen Barettin und seine Homologe ein hohes therapeutisches Potenzial, beispielsweise als Antimykotika, antimikrobielle Substanzen, Anthelminthika (Wurmmittel), Insektizide oder auch als Chemotherapeutika gegen Krebszellen.[7]
Bereits in geringen Konzentration von 0,25 bis 25 µmol verhindert Barettin die Ansiedlung von Seepocken-Larven.[8] Synthetische Barettin-Derivate zeigen in noch geringeren Konzentrationen (34 nmol) eine entsprechende Wirkung.[9]
An die humanen Serotonin-Rezeptoren (5-HT-Rezeptoren) 5-HT2A, 5-HT2C und 5-HT4 bindet Barettin selektiv und mit ähnlichen Konzentrationen wie das endogene Serotonin.[8]
Einzelnachweise
Bearbeiten- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ S. Sölter: Identifizierung und Synthese von Naturstoffen aus borealen Schwämmen. ( vom 23. September 2015 im Internet Archive) (PDF; 2,1 MB), Dissertation, Universität Hamburg, 2004.
- ↑ G. Lidgren, L. Bohlin: Tetrahedron Lett. 1986, 28, 3283–4.
- ↑ A. Lieberknecht, H. Griesser: What is the structure of barettin? Novel synthesis of unsaturated diketopiperazines. In: Tetrahedron Letters, 28/1987, S. 4275–8.
- ↑ S. Sölter: Barettin, revisited? In: Tetrahedron Letters, 43/2002, S. 3385–6.
- ↑ M. Sjögren u. a.: Antifouling activity of brominated cyclopeptides from the marine sponge Geodia barretti. In: J Nat Prod, 67/2004, S. 368–72, PMID 15043412.
- ↑ S. Bittner u. a.: The five bromotryptophans. In: Amino Acids, 33/2007, S. 19–42, PMID 17031473.
- ↑ a b E. Hedner u. a.: Brominated cyclodipeptides from the marine sponge Geodia barretti as selective 5-HT ligands. In: J Nat Prod, 69/2006, S. 1421–1424, PMID 17067154.
- ↑ M. Sjögren u. a.: Antifouling activity of synthesized peptide analogs of the sponge metabolite barettin. In: Peptides, 27/2006, S. 2058–2064, PMID 16781016.
Literatur
Bearbeiten- A. L. Johnson u. a.: Synthesis of barettin. In: Tetrahedron, 60/204, S. 961–5.
- M. Sjögren: Bioactive Compounds from the Marine Sponge Geodia barretti: Characterization, Antifouling Activity and Molecular Targets., Dissertation, Universität Uppsala, 2006.
- E. Hedner: Bioactive Compounds in the Chemical Defence of Marine Sponges: Structure-Activity Relationships and Pharmacological Targets., Dissertation, Universität Uppsala, 2007.