Bariumbromid ist eine chemische Verbindung des Bariums und zählt zu den Bromiden. Es ist ein farbloser hochschmelzender Feststoff.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Ba2+ _ Br− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bariumbromid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | BaBr2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 297,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
3,58 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
847 °C[2] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (1041 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,5 mg·m−3 [2] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−757,3 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte Bearbeiten
Bariumbromid spielt in der Entdeckung der Radioaktivität und der Kernspaltung eine Rolle. Da Barium- und Radiumverbindungen ähnliche Eigenschaften besitzen, ist es nicht einfach diese zu trennen. Eine Möglichkeit ist die fraktionierte Kristallisation geeigneter Salze. Zunächst wurden von Marie Curie hierfür die Chloride genutzt. Diese ermöglichen jedoch nur eine langsame und damit aufwändige Trennung. Deutlich bessere Trennungen mit höheren Anreichungsraten ermöglichen die Bromide.[5][6]
Diese Anreicherung wurde bei der Entdeckung der Kernspaltung durch Otto Hahn wichtig, als das bei der Bestrahlung von Uran mit Neutronen erhaltene Produkt zunächst für Radium gehalten wurde. Erst durch die unerwartete Reaktion bei der fraktionierten Kristallisation erkannten er und Fritz Straßmann, dass es sich um radioaktive Bariumisotope und nicht um Radium handelt und dass damit eine Kernspaltung erfolgt sein musste.[6]
Gewinnung und Darstellung Bearbeiten
Wasserhaltiges Bariumbromid-Dihydrat fällt beim Einengen barium- und bromidhaltiger wässriger Lösungen aus. Oberhalb von 120 °C wird das Kristallwasser abgegeben und es bildet sich das wasserlose Salz.[7]
Weitere Möglichkeiten zur Gewinnung von Bariumbromid sind die Reaktion von Bariumsulfid oder Bariumcarbonat mit Bromwasserstoffsäure.[7]
Eigenschaften Bearbeiten
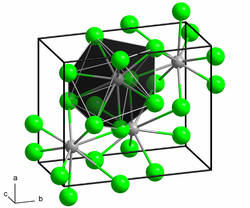
Wie Bariumchlorid und Bariumiodid kristallisiert Bariumbromid in der Blei(II)-chloridstruktur.[8]
In der Gasphase sind Bariumbromid-Moleküle entgegen den Vorhersagen des VSEPR-Modells nicht linear, sondern mit einem Winkel von 146° gewinkelt. Verantwortlich hierfür sind relativistische Effekte.[9]
Verwendung Bearbeiten
Außer bei Trennung von Barium und Radium, die auf Grund der Gefahren durch das radioaktive Radium nur noch von geringer Bedeutung ist, wird Bariumbromid für die Herstellung von Chemikalien für die Photographie und zur Gewinnung anderer Bromide genutzt.[7]
Einzelnachweise Bearbeiten
- ↑ Datenblatt Barium bromide anhydrous, beads, −10 mesh, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 17. Januar 2012 (PDF).
- ↑ a b c d e f Eintrag zu Bariumbromid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag barium salts, with the exception of barium sulphate, salts of 1-azo-2-hydroxynaphthalenyl aryl sulphonic acid, and of salts specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-6.
- ↑ Marie Curie: Radium and the New Concepts in Chemistry. Nobelpreis-Rede, Stockholm, 11. Dezember 1911.
- ↑ a b Günther Hermann: Vor fünf Jahrzehnten: Von den Transuranen zur Kernspaltung. In: Angewandte Chemie. 1990, 102, 5, S. 469–496, doi:10.1002/ange.19901020504.
- ↑ a b c Pradyot Patnaik: Handbook of inorganic chemicals. McGraw-Hill Professional, 2003, S. 81, ISBN 978-0-070-49439-8.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1241.
- ↑ Luis Seijo, Zoila Barandiarán, Sigeru Huzinaga: Ab initio model potential study of the equilibrium geometry of alkaline earth dihalides: MX2 (M=Mg, Ca, Sr, Ba; X=F, Cl, Br, I). In: J. Chem. Phys. 1991, 94, S. 3762, doi:10.1063/1.459748.
