Amavadin
Amavadin ist eine anionische Komplexverbindung des Vanadiums.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
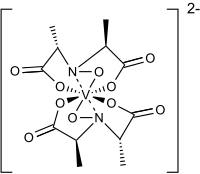
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Amavadin | ||||||||||||
| Andere Namen |
Bis[N-[(1S)-1-(carboxy-κO)ethyl]-N-(hydroxy-κO)-L-alaninato(2−)-.κN,κO]-vanadium | ||||||||||||
| Summenformel | [V{NO[CH(CH3)CO2]2}2]2− | ||||||||||||
| Kurzbeschreibung |
in Lösung hellblau[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 398,94 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Vorkommen
BearbeitenDie Verbindung wurde in drei Pilzarten der Gattung Amanita nachgewiesen. Der Fliegenpilz (A. muscaria), der Königs-Fliegenpilz (A. regalis) und A. velatipes reichern Vanadium in bis zu 400-mal höheren Konzentrationen an als andere Pilze oder Pflanzen.[1] Amavadin wurde erstmals 1972 von Kneifel und Bayer isoliert.[3]
Synthese
BearbeitenDie Synthese von Amavadin gelingt über die Komplexbildung von Vanadylacetat mit dem vierzähnigen Liganden N-Hydroxyimino-2,2'-dipropionsäure.[4]
Bei dem Anion handelt es sich um eine achtfach koordinierte Vanadiumverbindung. Lösungen der Verbindung erscheinen blau.[1] Mit einem Calcium-Ion (Ca2+) als Gegenion gelang es, Kristalle für die Kristallstrukturanalyse zu erhalten.[1]
-
3D-Model des Anions Amavadin
Struktur und Eigenschaften
BearbeitenDas Vanadium-Ion in Amavadin ist vierfach positiv geladen (V4+). Die Einkristall-Strukturanalyse dieser Verbindung zeigte, dass es sich um einen achtfach koordinierten Vanadiumkomplex handelt.[5] Das Vanadium-Ion ist darin an zwei vierzähnige Liganden gebunden. Diese leiten sich von der N-Hydroxyimino-2,2′-dipropionsäure ab, H3(HIDPA). Der Ligand wurde erstmals 1954 synthetisiert.[6] Die Liganden koordinieren über das Stickstoffatom und über drei Sauerstoffatome an das Vanadium-Ion. Das Vanadiumatom in dieser Komplexverbindung kann auch zum Vanadium(V) oxidiert werden. Der oxidierte Komplex wurde mittels NMR-Spektroskopie untersucht.[7]
Amavadin besitzt fünf chirale Zentren. Eins am Vanadium-Ion und vier an den α-Kohlenstoffatomen der Liganden. Die chiralen Kohlenstoffatome der Liganden haben S-Konfiguration.
Anwendung
BearbeitenDie homologen Amavadinverbindungen [V(HIDPA)2]2- und [V(HIDA)2]2- zeigen eine Reduktion von Nitrit zu NO2 und eine Oxidation von Wasser zu Sauerstoff. Da Nitrit als Schadstoff in Trinkwasser und Abwasser enthalten ist, bietet die katalytische Wirkung von Amavadin eine Möglichkeit zur Reinigung des Wassers.[8] Die Reaktion ist leicht endergonisch und stark vom pH-Wert abhängig. Die Rückreaktion findet erst nach Stunden oder Tagen statt.[8]
Biologische Funktion
BearbeitenDie biologische Funktion von Amavadin ist immer noch unbekannt. Es wird vermutet, dass die Verbindung unter Verwendung von Wasserstoffperoxid als Peroxidase zur Regeneration von beschädigtem Gewebe wirkt.[7] Amavadin könnte auch als Toxin zum Schutz des Pilzes dienen.[9]
Bei der Nitrit Reduktion mittels Amavadinkatalysator ist NO als Intermediat beteiligt. Da dieses Molekül bei vielen Organismen, wie auch beim Menschen, als Neurotransmitter dient, wird eine biologische Wirkweise beim Fliegenpilz vermutet.[8]
Einzelnachweise
Bearbeiten- ↑ a b c d Robert E. Berry, Elaine M. Armstrong u. a.: The Structural Characterization of Amavadin. In: Angewandte Chemie International Edition. 38, 1999, S. 795, doi:10.1002/(SICI)1521-3773(19990315)38:6<795::AID-ANIE795>3.0.CO;2-7. PMID 29711812.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Kneifel, E. Bayer: Stereochemistry and total synthesis of amavadin, the naturally occurring vanadium compound of Amanita muscaria. In: Journal of the American Chemical Society. 108, 1986, S. 3075, doi:10.1021/ja00271a043.
- ↑ Simone Braeuer, Martin Walenta, Lorenz Steiner, Walter Goessler: Determination of the naturally occurring vanadium-complex amavadin in Amanita muscaria with HPLC-ICPMS. In: Journal of Analytical Atomic Spectrometry. Band 36, Nr. 5, 12. Mai 2021, S. 954–967, doi:10.1039/D0JA00518E.
- ↑ Elaine M. Armstrong, Roy L. Beddoes, Louise J. Calviou, John M. Charnock, David Collison, Nigar Ertok, James H. Naismith, C. David Garner: The chemical nature of amavadin. In: Journal of the American Chemical Society. 115, 1993, S. 807, doi:10.1021/ja00055a073.
- ↑ Shou-Cheng J. Fu, Sanford M. Birnbaum, Jesse P. Greenstein: Influence of Optically Active Acyl Groups on the Enzymatic Hydrolysis of N-Acylated-L-amino Acids. In: Journal of the American Chemical Society. 76, 1954, S. 6054, doi:10.1021/ja01652a057.
- ↑ a b Ton Hubregtse, Ernst Neeleman u. a.: The first enantioselective synthesis of the amavadin ligand and its complexation to vanadium. In: Journal of Inorganic Biochemistry. 99, 2005, S. 1264, doi:10.1016/j.jinorgbio.2005.02.004. PMID 15833352.
- ↑ a b c Lúcia Dias, Nihel Bekhti, Maxim L. Kuznetsov, José A. B. Ferreira, Maria C. Bacariza, José Armando L. da Silva: Nitrite Reduction in Aqueous Solution Mediated by Amavadin Homologues: N2O Formation and Water Oxidation. In: Chemistry - A European Journal. Band 24, Nr. 10, 19. Januar 2018, S. 2474–2482, doi:10.1002/chem.201705385.
- ↑ C. David Garner, Elaine M Armstrong, Robert E Berry, Roy L Beddoes, David Collison, J.Jon A Cooney, S. Nigar Ertok, Madeleine Helliwell: Investigations of Amavadin. In: Journal of Inorganic Biochemistry. 80, 2000, S. 17, doi:10.1016/S0162-0134(00)00034-9. PMID 10885458.