Aluminiumsulfat
Aluminiumsulfat, Summenformel Al2(SO4)3, ist eine chemische Verbindung des Aluminiums aus der Gruppe der Sulfate. Es bildet ein farbloses Pulver mit einer Dichte von 2,71 g/cm3.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
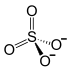
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Aluminiumsulfat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | Al2(SO4)3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 342,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||||||||
| Dichte |
2,71 g·cm−3[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht in Wasser (360 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
6 mg·m−3 (Al)[5] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−3442 kJ·mol−1[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||

Vorkommen
BearbeitenIn der Natur kommt Aluminiumsulfat in Form des Minerals Alunogen vor. Weiterhin kann es aus natürlich vorkommenden Alaunen gewonnen werden.
Synthese
BearbeitenDas Hydrat des Aluminiumsulfats lässt sich durch Auflösen von reinem Aluminiumoxid oder Aluminiumhydroxid in konzentrierter Schwefelsäure gewinnen.[3]
Reaktionsverhalten
BearbeitenMit saurer Reaktion löst sich Aluminiumsulfat in Wasser und kristallisiert bei Zimmertemperatur als monoklines Al2(SO4)3 · 18 H2O aus. Ab einer Temperatur von 340 °C findet eine vollständige Dehydratisierung des Salzes statt und oberhalb von 770 °C zerfällt es in Aluminiumoxid und Schwefeltrioxid.
Aluminiumsulfat bildet mit den Sulfaten einwertiger Metalle Doppelsalze gemäß folgender Formel (Alaune):
Verwendung
BearbeitenAluminiumsulfat findet folgende Verwendungen:
- Retentionsmittel und zur Leimung in der Papierherstellung[3]
- Flockungsmittel in der Trinkwasseraufbereitung und Abwasseraufbereitung[3]
- Beizmittel in der Färberei
- Saatgutbeize
- Bestandteil von Schaumlöschmitteln
- Flammschutzmittel[7][8]
- Isoliersalz (auf frischen Zement- oder Kalkuntergründen, gegen Wasser- und Nikotinflecken) in der Renovierung
- Inhaltsstoff von Pflanzenstärkungs- und schutzmitteln[9] und zur Blaufärbung von Hortensien
- Festigungsmittel bzw. Stabilisator in Lebensmitteln, in der EU als Lebensmittelzusatzstoff E 520 zugelassen.
Unfälle und Gesundheitsgefahren
BearbeitenBei einem Vorfall mit Aluminiumsulfat im Trinkwasser in Camelford in Cornwall in England trank im Juli 1988 eine Reihe von Menschen Trinkwasser mit größeren Konzentrationen an Aluminiumsulfat. Die zulässigen Grenzwerte waren um das 5000-fache überschritten. Nach dem Unfall klagten zahlreiche Anwohner unter anderem über Geschwüre, Hautausschlag und Gedächtnisprobleme. Ein Todesfall im Jahr 2006 hat eine Debatte über Spätfolgen des Unglücks intensiviert[10]. Die Untersuchungen der langfristigen Auswirkungen auf die Gesundheit nach diesem Vorfall sind noch immer nicht vollständig abgeschlossen, aber es wurden in Post-Mortem-Untersuchungen besonders stark erhöhte Aluminium-Konzentrationen in den Gehirnen der Opfer festgestellt und weitere Untersuchungen in Auftrag gegeben, um festzustellen, ob es einen Zusammenhang mit Zerebraler Amyloidangiopathie gibt.[11]
Aluminiumsulfat wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Aluminiumsulfat waren die Besorgnisse bezüglich Verbraucherverwendung, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen und der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Frankreich durchgeführt.[12]
Bezeichnung Alaun
BearbeitenPapiermacher bezeichnen chemisch unkorrekt Aluminiumsulfat als Alaun.[13]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu E 520: Aluminium sulphate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ Eintrag zu ALUMINUM SULFATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 13. Februar 2020.
- ↑ a b c d e Eintrag zu Aluminiumsulfat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ a b c d Eintrag zu Aluminiumsulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt Aluminiumsulfat (wasserfrei) bei Alfa Aesar, abgerufen am 31. Januar 2010 (Seite nicht mehr abrufbar).
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ Artikel über den Einsatz von Aluminiumsulfat als Flammschutzmittel in Dämmstoffen aus nachwachsenden Rohstoffen auf EnBauSa.de; abgerufen im Sept. 2016
- ↑ Marktübersicht - Dämmstoffe aus nachwachsenden Rohstoffen der Fachagentur nachwachsende Rohstoffe, siehe Tabelle auf S. 29; abgerufen im September 2016
- ↑ Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: Deklaration von Wirkstoffen, die als Beistoffe in Pflanzenschutzmitteln enthalten sind. ( vom 8. Dezember 2015 im Internet Archive) (Stand: 1. Dezember 2009).
- ↑ Poisoned: The Camelford scandal. The Independent, 16. April 2006, abgerufen am 30. März 2011 (englisch).
- ↑ Nigel Hawkes: Alzheimers linked to aluminium pollution in tap water In: The Times, 20. April 2006. Abgerufen am 7. April 2010 (englisch).
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Aluminium sulphate, abgerufen am 28. November 2023.
- ↑ Taschenbuch der Papiertechnik, Jürgen Blechschmidt, Carl Hanser Verlag GmbH & Co. KG, 2010 e ISBN 978-3-446-42322-0 Print ISBN 978-3-446-41967-4, doi:10.3139/9783446423220

![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
![{\displaystyle \mathrm {\ \!\ {\Biggr ]}_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd32744e9f4314d390f5ee107a8bd812d0cc2da0)
