Actinium(III)-fluorid
Actinium(III)-fluorid ist eine chemische Verbindung der Elemente Actinium und Fluor.
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
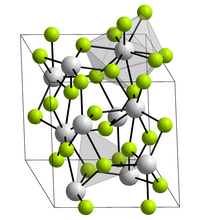
| _ Ac3+ _ F− | |||||||
| Kristallsystem | |||||||
| Raumgruppe |
P3c1 (Nr. 165) | ||||||
| Gitterparameter |
a = 741 pm | ||||||
| Koordinationszahlen |
Ac[9], F[3] | ||||||
| Allgemeines | |||||||
| Name | Actinium(III)-fluorid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | AcF3 | ||||||
| Kurzbeschreibung |
weißer Feststoff[2] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 284,02 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte | |||||||
| Gefahren- und Sicherheitshinweise | |||||||
 Radioaktiv | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Darstellung
BearbeitenActinium(III)-fluorid kann entweder in Lösung oder durch Feststoffreaktion dargestellt werden. Im ersten Fall gibt man bei Raumtemperatur Flusssäure zu einer Ac3-Lösung und fällt das Produkt aus.
Im anderen Fall wird Actinium-Metall mit Fluorwasserstoff bei 700 °C in einer Platinapparatur behandelt.[3][4]
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenActinium(III)-fluorid ist ein weißer Feststoff. Es kristallisiert trigonal in der Raumgruppe P3c1 (Raumgruppen-Nr. 165) mit den Gitterparametern a = 741 pm und c = 755 pm sowie sechs Formeleinheiten pro Elementarzelle.[1]
Chemische Eigenschaften
BearbeitenDie Umsetzung von Actinium(III)-fluorid mit feuchtem Ammoniak bei 900–1000 °C liefert das Oxifluorid AcOF.
Während Lanthanoxifluorid leicht durch das Erhitzen von Lanthan(III)-fluorid in Luft bei 800 °C in etwa einer Stunde entsteht, ergibt eine ähnliche Behandlung von Actinium(III)-fluorid kein AcOF und führt nur zu einer Schmelze der ursprünglichen Substanz.[3][4]
Sicherheitshinweise
BearbeitenEinstufungen nach der GHS-Verordnung liegen nicht vor, weil diese nur die chemische Gefährlichkeit umfassen, die eine völlig untergeordnete Rolle gegenüber den auf der Radioaktivität beruhenden Gefahren spielt. Auch Letzteres gilt nur, wenn es sich um eine dafür relevante Stoffmenge handelt.
Einzelnachweise
Bearbeiten- ↑ a b W. H. Zachariasen: Crystal Chemical Studies of the 5f-Series of Elements. XII. New Compounds Representing known Structure Types. In: Acta Crystallographica. 2, 1949, S. 388–390, doi:10.1107/S0365110X49001016.
- ↑ Gerd Meyer, Lester R. Morss: Synthesis of lanthanide and actinide compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 71 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Sherman Fried, French Hagemann, W. H. Zachariasen: The Preparation and Identification of Some Pure Actinium Compounds. In: J. Am. Chem. Soc. 72, 1950, S. 771–775, doi:10.1021/ja01158a034.
- ↑ a b c Gerd Meyer, Lester R. Morss: Synthesis of lanthanide and actinide compounds. Springer, 1991, ISBN 0-7923-1018-7, S. 87–88 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.