4-Bromresorcin
4-Bromresorcin ist eine chemische Verbindung, die zur Stoffgruppe der Phenole gehört. Es ist neben dem 2-Bromresorcin und dem 5-Bromresorcin eines der drei stellungsisomeren Monobromderivate des Resorcins (1,3-Dihydroxybenzol).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
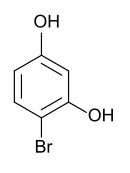
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Bromresorcin | ||||||||||||||||||
| Andere Namen |
4-Brombenzol-1,3-diol | ||||||||||||||||||
| Summenformel | C6H5BrO2 | ||||||||||||||||||
| Kurzbeschreibung |
blassrote geruchlose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 189,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
150 °C (16 hPa)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Darstellung
Bearbeiten4-Bromresorcin kann aus 2,4-Dihydroxybenzoesäure über 5-Brom-2,4-dihydroxybenzoesäure als Zwischenstufe hergestellt werden.[3] Die 2,4-Dihydroxybenzoesäure ist aus Resorcin durch Kolbe-Schmitt-Reaktion mit Kaliumhydrogencarbonat zugänglich.[4]
Ein anderer Syntheseweg geht vom Resorcin über das 4,6-Dibromresorcin, von dem ein Bromatom mit Natriumsulfat / Natriumhydroxid wieder entfernt wird.[5]
Reaktionen
BearbeitenDie Einführung einer Acetylgruppe liefert 1-(5-Brom-2,4-dihydroxyphenyl)-ethanon (CAS-Nummer: 60965-25-5) und kann entweder durch eine Nencki-Reaktion mit Zinkchlorid[6] oder durch Fries-Umlagerung des Diacetats mit Aluminiumchlorid durchgeführt werden.[6]
4-Bromresorcin ist ein Synthesebaustein zur Darstellung von 6-Brom-substituierten Cumarinen – z. B. entsteht durch eine Kondensationsreaktion mit Acetessigester 6-Brom-7-Hydroxy-4-Methylcumarin.[7]
Ebenso entsteht durch Reaktion mit Äpfelsäure 6-Brom-7-Hydroxycumarin.[8]
Einzelnachweise
Bearbeiten- ↑ a b c Eintrag zu 4-Bromoresorcinol bei Thermo Fisher Scientific, abgerufen am 13. Oktober 2023.
- ↑ a b Datenblatt 4-Bromoresorcinol bei Sigma-Aldrich, abgerufen am 18. März 2011 (PDF).
- ↑ R. B. Sandin, R. A. McKee: 4-Bromoresorcinol In: Organic Syntheses. 17, 1937, S. 23, doi:10.15227/orgsyn.017.0023; Coll. Vol. 2, 1943, S. 100 (PDF).
- ↑ M. Nierenstein, D. A. Clibbens: β-Resorcylic Acid In: Organic Syntheses. 10, 1930, S. 94, doi:10.15227/orgsyn.010.0094; Coll. Vol. 2, 1943, S. 557 (PDF).
- ↑ E. Kiehlmann, R. W. Lauener: Bromophloroglucinols and their methyl ethers. In: Canadian Journal of Chemistry. 67, 1989, S. 335–344, doi:10.1139/v89-055.
- ↑ a b R. Martin: Handbook of Hydroxyacetophenones Set: Preparation and Physical Properties. Springer Verlag, 2005, ISBN 1-4020-2290-5, S. 26 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ The Zebrafish: Genetics, Genomics and Informatics: Genetics, Genomics and ... Academic Press, 2004, ISBN 0-08-052251-3, S. 161 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Indian Journal of Chemistry. Council of Scientific & Industrial Research, 2009, ISBN 0-470-18832-4, S. 262 (eingeschränkte Vorschau in der Google-Buchsuche).
