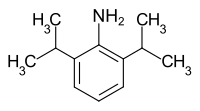
2,6-Diisopropylanilin
2,6-Diisopropylanilin ist ein flüssiges aromatisches Amin mit der Formel H2NC6H3(CH(CH3)2)2. Es ist in Reinform eine farblose Flüssigkeit, genau wie viele andere Anilinderivate kann es bei Luftkontakt durch Oxidationsprozesse gelb oder braun vorliegen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,6-Diisopropylanilin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H19N | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche geruchlose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 177,29 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,94 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
−45 °C[1] | ||||||||||||||||||
| Siedepunkt |
257 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
< 0,2 g/l in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||

Verwendung Bearbeiten
Aufgrund seines hohen sterischen Anspruchs wird 2,6-Diisopropylanilin zur Synthese von Liganden in der Koordinationschemie genutzt. So tragen viele auf Schrock-Carben basierende Übergangsmetallkomplexe von diesem Anilin abgeleitete Imidoliganden.[2] Die Kondensation mit 2,6-Diacetylpyridin führt zu Diiminopyridinliganden[3], die mit Acetylaceton zu NacNac-Liganden.[4]
Auch in einigen Carbenen werden die sterisch anspruchsvollen Diisopropylphenylsubstituenten durch 2,6-Diisopropylanilin eingeführt.[5][6][7]
-
Ein typischer schrockartiger Katalysator der Olefinmethathese, der ein auf 2,6-Diisopropylanilin basierendes sterisch anspruchsvolles Imin als Beobachterligand trägt.
-
Struktur des Diamido-diimidokomplexes W(NAr)2(N(H)Ar)2 (ArNH2 = 2,6-Diisopropylanilin).
Einzelnachweise Bearbeiten
- ↑ a b c d e f g h i Eintrag zu 2,6-Diisopropylanilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. November 2019. (JavaScript erforderlich)
- ↑ Richard R. Schrock: Recent Advances in High Oxidation State Mo and W Imido Alkylidene Chemistry. In: Chemical Reviews. Band 109, Nr. 8, 12. August 2009, S. 3211–3226, doi:10.1021/cr800502p, PMID 19284732, PMC 2726908 (freier Volltext).
- ↑ Vernon C. Gibson, Martin J. Humphries, Kilian P. Tellmann, Duncan F. Wass, Andrew J. P. White: [No title found]. In: Chemical Communications. Nr. 21, 23. Oktober 2001, S. 2252–2253, doi:10.1039/b107490c.
- ↑ Complexes of Bulky β-Diketiminate Ligands. In: Inorganic Syntheses. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-65156-8, S. 1–55, doi:10.1002/9780470651568.ch1.
- ↑ Vincent Lavallo, Yves Canac, Carsten Präsang, Bruno Donnadieu, Guy Bertrand: Stable Cyclic (Alkyl)(Amino)Carbenes as Rigid or Flexible, Bulky, Electron-Rich Ligands for Transition-Metal Catalysts: A Quaternary Carbon Atom Makes the Difference. In: Angewandte Chemie International Edition. Band 44, Nr. 35, 5. September 2005, S. 5705–5709, doi:10.1002/anie.200501841.
- ↑ Matthew Asay, Bruno Donnadieu, Antoine Baceiredo, Michele Soleilhavoup, Guy Bertrand: Cyclic (Amino)[bis(ylide)]carbene as an Anionic Bidentate Ligand for Transition-Metal Complexes. In: Inorganic Chemistry. Band 47, Nr. 10, Mai 2008, S. 3949–3951, doi:10.1021/ic800459p, PMID 18422308, PMC 2574712 (freier Volltext).
- ↑ Tianniu Chen, Karn R Sorasaenee, Zhongzhi Wu, Jonathan B Diminnie, Ziling Xue: Synthesis, characterization and X-ray structures of new molybdenum bis(imide) amide and silyl complexes. In: Inorganica Chimica Acta. Band 345, März 2003, S. 113–120, doi:10.1016/S0020-1693(02)01271-9.